Попередня сторінка: 16. Фенол
Наступна сторінка: 18. Карбоновые кислоты
Материал параграфа поможет вам:
- узнать о классе органических соединений — альдегидах;
- давать альдегидам систематические названия;
- получить представление о строении молекул альдегидов;
- выяснить свойства альдегидов, способы их получения и сферы применения.
Известно много органических веществ, в молекулах которых имеется двойная связь между атомами Карбона и Оксигена. Группу атомов
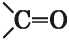
называют карбонильной группой.
Она может быть соединена с углеводородным остатком и атомом Гидрогена:
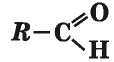

Это — общая формула веществ, название которых — альдегиды. В молекуле простейшего альдегида карбонильная группа связана
с двумя атомами Гидрогена:
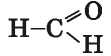
Группу атомов
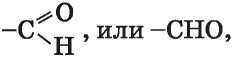
называют
альдегидной группой', она является характеристической группой соответствующего класса органических соединений.
Альдегиды — производные углеводородов, в молекулах которых атом Гидрогена замещен на альдегидную группу1.
Название «альдегид» состоит из частей (они подчеркнуты) иноязычных слов alcohol (спирт) и dehydrogenatum (лишенный Гидрогена). Действительно, молекула любого альдегида (например CH3CHO) содержит на два атома Гидрогена меньше, чем молекула соответствующего спирта (CH3-CH2OH).
Общая формула насыщенных альдегидов —
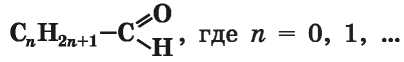
(упрощенный
вариант формулы — CmH2mO; m = 1, 2, ...).
Названия. Систематическое название альдегида состоит из названия соответствующего углеводорода (при этом учитывают все атомы
1 В молекуле простейшего альдегида эта группа атомов соединена с атомом Гидрогена.
главной карбоновой цепи в молекуле альдегида) и суффикса -алъ. Нумерацию в цепи начинают с атома Карбона альдегидной группы. Примеры формул и названий альдегидов:
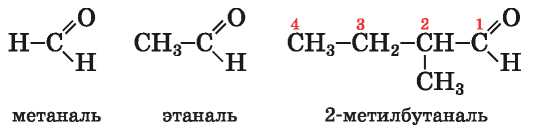
Модели молекул метаналя и этаналя представлены на рисунке 43.
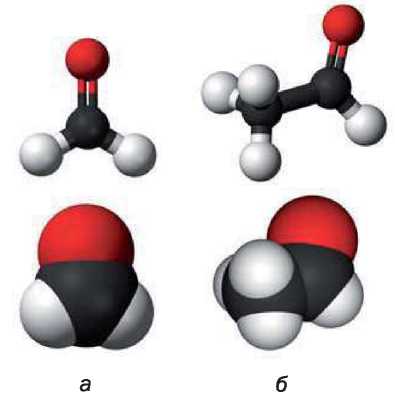
Рис. 43.
Модели молекул: а — метаналя; б — этаналя
Изобразите структурную формулу молекулы 2,2-диметилбутаналя.
Тривиальные названия альдегидов происходят от названий соответствующих карбоновых кислот (с. 117). Простейший альдегид HCHO называют муравьиным, альдегид CH3CHO — уксусным1.
Строение молекул. В молекуле альдегида атом Карбона карбонильной группы
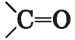
со
единен с тремя атомами ковалентной связью, которая образовалась при перекрывании измененных по форме орбиталей. Эти четыре
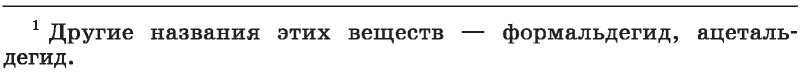
атома находятся в одной плоскости, а углы между прямыми, соединяющими их центры, равны 120°. р-Орбитали атома Карбона и атома Оксигена перекрываются над и под этой плоскостью (рис. 44). Электронная плотность двойной связи смещена к атому наиболее электроотрицательного элемента Оксигена:
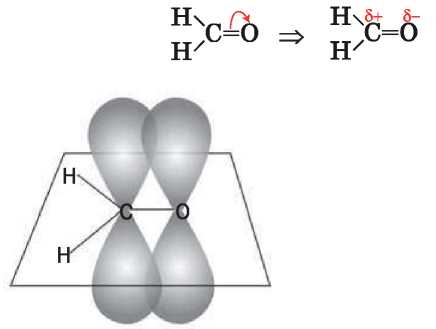
Рис. 44.
Перекрывание р-орбиталей атомов Карбона и Оксигена в молекуле метаналя
Физические свойства. Простейший альдегид — метаналь — в обычных условиях является газом, имеет резкий запах и хорошо растворяется в воде. Этаналь и другие альдегиды с небольшими молекулярными массами — жидкости с неприятным, иногда удушливым запахом, растворимые в воде. Остальные альдегиды — твердые вещества, которые не растворяются в воде.
Чем обусловлена растворимость некоторых альдегидов в воде?
Температуры кипения альдегидов ниже, чем соответствующих спиртов. Это объясняется отсутствием водородных связей между молекулами альдегида.
Химические свойства. Вследствие наличия в карбонильной группе двойной связи альдегиды могут вступать в реакции присоединения. Для веществ этого класса также характерны реакции окисления.
Реакции присоединения. Уксусный и другие альдегиды взаимодействуют с водородом
при наличии катализатора и превращаются в первичные спирты:
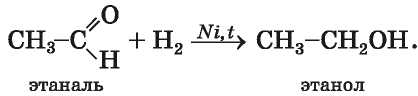
В таких реакциях альдегиды восстанавливаются. Суть восстановления органического соединения может состоять в увеличении количества атомов Гидрогена в его молекуле или уменьшении количества атомов Оксигена.
Реакции окисления. Альдегиды легко окисляются (кислородом воздуха, раствором калий перманганата, другими веществами) с образованием соответствующих карбоновых кислот:
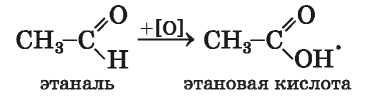
Это интересно
Оксид Ag2O реагирует с раствором аммиака; продукт взаимодействия — растворимое соединение Аргентума.
Окисление альдегида также происходит при его взаимодействии с аммиачным раствором аргентум(1) оксида при нагревании. На внутренних стенках пробирки, в которой проводят опыт, образуется блестящий слой серебра (рис. 45). Реакцию называют реакцией «серебряного зеркала»; она является качественной на альдегидную группу в молекуле органического вещества:

Продукт окисления альдегида — соль, образованная анионами карбоновой кислоты и катионами аммония NH4.

Рис. 45.
Пробирка с «серебряным зеркалом»
В другой качественной реакции на альдегидную группу используют свежеосажденный купрум(П) гидроксид. Если к этому веществу добавить альдегид и полученную смесь нагревать, то голубой цвет осадка изменяется до желтого вследствие образования купрум(1) гидроксида, а затем переходит в оранжево-красный, который имеет купрум(1) оксид (рис. 46):
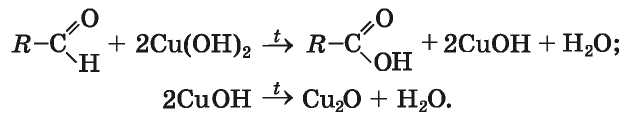
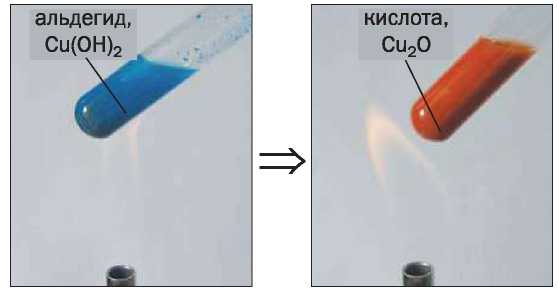
Рис. 46.
Реакция альдегида с купрум(И) гидроксидом
Альдегиды — горючие вещества.
Напишите уравнение реакции горения эта-нал я.
Получение. В промышленности альдегиды получают окислением первичных спиртов и алкенов, другими реакциями.
Методы получения уксусного альдегида (этаналя) основаны на реакциях окисления этена или этанола1:
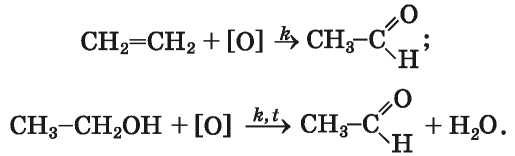

Раньше этаналь получали в промышленности гидратацией этина. Эта реакция протекает при нагревании, наличии сульфатной кислоты, а также катализатора — Mep-курий(П) сульфата:

Сейчас этаналь не получают таким способом из-за токсичности соединений Меркурия.
Применение. Метаналь, или формальдегид, является исходным веществом в производстве фенолоформальдегидных смол (с. 199). Водный раствор формальдегида с массовой долей вещества 40 % называют формалином. Его используют в качестве дезинфицирующего средства и консерванта биологических препаратов. Из уксусного альдегида производят уксусную кислоту, этиловый спирт, другие органические соединения. Некоторые альдегиды, имеющие приятный запах, применяют в парфюмерии.
Физиологическое действие. Многие альдегиды негативно влияют на нервную систему, раздражают кожу, вызывают аллергию. Метаналь и этаналь — канцерогенные вещества. Они содержатся в табачном дыме, газовых выбросах двигателей внутреннего сгорания. Метаналь может поступать в воздух из некоторых видов древесностружечных плит.
ВЫВОДЫ
Альдегиды — производные углеводородов, в молекулах которых атом Гидрогена замещен на альдегидную группу — СНО. Общая формула альдегидов R-СНО.
Систематическое название альдегида состоит из названия соответствующего углеводорода и суффикса -аль.
Метаналь в обычных условиях является газом, другие альдегиды — жидкости или твердые вещества. Соединения с небольшими относительными молекулярными массами растворяются в воде.
Для альдегидов характерны реакции присоединения и окисления. Альдегиды — горючие вещества.
Этаналь получают из этена, этанола.
Среди альдегидов наибольшее применение имеют метаналь и этаналь. Это — токсичные вещества.
120. Можно ли, исходя из строения молекулы этаналя, предсказать химические свойства соединения? Ответ обоснуйте.
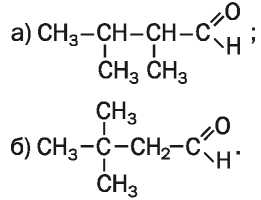
121. Дайте систематические названия веществам с такими формулами:
122. Изобразите структурные формулы молекул 2-метилпентаналя и 3-этилгексаналя.
123. Назовите соединения, образующиеся при восстановлении:
а) метаналя;
б) пропаналя.
124. Составьте уравнения реакций окисления спиртов с образованием:
а) метаналя;
б) пропаналя.
125. Запишите в общем виде уравнение реакции окисления насыщенного одноатомного спирта в альдегид.
126. Выведите формулу альдегида, имеющего относительную молекулярную массу 86 и четвертичный атом Карбона в молекуле.
127. В результате реакции между 100 г раствора этаналя с массовой долей альдегида 40 % и аммиачным раствором аргентум(1) оксида выделилось 21,6 г серебра. Весь ли этаналь прореагировал? Дайте ответ на основании расчетов.
ДЛЯ ЛЮБОЗНАТЕЛЬНЫХ
Ацетон
Ацетон CH3COCH3 — один из наиболее распространенных органических растворителей (рис. 47). Его используют в быту для разбавления красок, выведения пятен, очистки различных поверхностей от органических загрязнений.

Рис. 47.
Емкость с ацетоном
Структурная формула молекулы ацетона
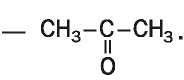
В этой
молекуле, как и в молекулах альдегидов, имеется карбонильная
группа
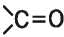
но она соединена с двумя углеводородными остатками
(рис. 48). Ацетон относится к кетонам — веществам с общей формулой
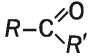
(углеводородные остатки могут быть одинаковыми либо
разными). У этого соединения есть изомер среди альдегидов:

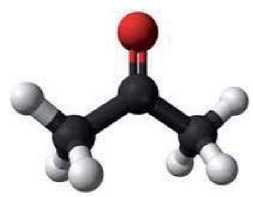
Рис. 48.
Модель
молекулы
ацетона
Ацетон — бесцветная легковоспламеняющаяся жидкость со специфическим запахом, которая неограниченно растворяется в воде
и кипит при температуре +56,5 °С. В отличие от альдегидов ацетон не реагирует с аммиачным раствором аргентум(1) оксида, а также с купрум(И) гидроксидом в щелочной среде.
Химическая промышленность потребляет значительные количества ацетона. Он служит растворителем красок, лаков, синтетических смол, используется в производстве ацетатного шелка, органического стекла, фото- и кинопленки.
Это материал учебника Химия 10 класс Попель, Крикля
Наступна сторінка: 18. Карбоновые кислоты