Попередня сторінка: 16. Массовая доля элемента в сложном ве�...
Наступна сторінка: 18. Оксиген. Кислород
Материал параграфа поможет вам:
- выяснить различия между физическими и химическими явлениями (химическими реакциями);
- понять роль химических реакций в природе, их значение для человека;
- определять химические свойства веществ.
На уроках природоведения вы узнали, что в природе происходят различные физические и химические явления.
Физические явления. Каждый из вас наблюдал за тем, как тает лед, кипит или замерзает вода. Лед, вода и водяной пар состоят из одних и тех же молекул и поэтому являются одним веществом, которое существует в разных агрегатных состояниях.
Явления, при которых вещества не превращаются в другие, называют физическими.
К физическим явлениям относятся не только изменения агрегатного состояния веществ, но и свечение сильно нагретого металла или камня, прохождение электрического тока в металлах, распространение запаха веществ в воздухе, растворение жира в бензине, притя
гивание железа к магниту и т. п. Такие явления изучает наука физика.
Химические явления (химические реакции). Одним из видов химических явлений является горение. Рассмотрим, как горит спирт (рис. 48). Этот процесс происходит при участии кислорода, который содержится в воздухе. Спирт сгорает, его количество уменьшается. Кажется, что он переходит в газообразное состояние подобно тому, как вода при нагревании превращается в пар. Но это не так. Если газ, полученный в результате сгорания спирта, охладить, то часть его сконденсируется в жидкость, но не в спирт, а в воду. Другая часть газа останется. С помощью специального опыта можно доказать, что этим остатком является углекислый газ.

Рис. 48.
Горение
спирта
Явления, при которых одни вещества превращаются в другие, называют химическими явлениями, или химическими реакциями.
Вещества, вступающие в химическую реакцию, называют исходными веществами, или реагентами, а те, которые образуются, — конечными веществами, или продуктами реакции.
Суть рассмотренной химической реакции передает такая запись:
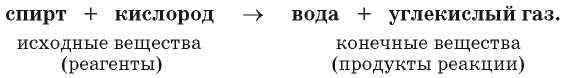
Реагенты и продукты этой реакции состоят из молекул. Во время горения создается высокая температура. В таких условиях молекулы реагентов распадаются на атомы, которые, соединяясь, образуют молекулы новых веществ — продуктов1. Следовательно, все атомы во время реакции сохраняются.
Внешние эффекты, сопровождающие химические реакции. Наблюдая за протеканием химических реакций, можно зафиксировать:
• появление, исчезновение или изменение окраски веществ (рис. 49, а);
• выделение газа (рис. 49, б);
• образование или растворение осадка (рис. 49, в);
• появление, исчезновение или изменение запаха;
• выделение или поглощение теплоты;
• появление пламени (рис. 48), иногда — свечение.
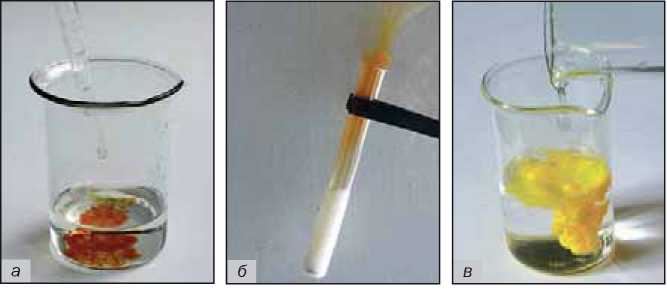
Рис. 49.
Внешние эффекты при химических реакциях: а — появление окраски; б — выделение газа; в — образование осадка
1 Известны и другие варианты взаимодействия частиц реагентов.
ЛАБОРАТОРНЫЙ ОПЫТ № 3
Проведение химических реакций
Вам выданы растворы кальцинированной соды и фенолфталеина. Окрашены ли они? Налейте в пробир-
ку 1 мл раствора соды и добавьте 1—2 капли раствора фенолфталеина. Что наблюдаете?
Налейте в две пробирки по 1 мл раствора соды. В одну пробирку добавьте 1 мл разбавленной нитратной кислоты, а в другую — 1 мл раствора медного купороса. Что происходит в каждой пробирке?
Указанные внешние эффекты, кроме появления пламени, вы можете наблюдать и при физических явлениях.
Пример 1. Порошок серебра, полученный в пробирке в результате химической реакции, имеет серый цвет. Если его расплавить, а затем расплав охладить, то получим слиток металла, но не серого, а белого цвета, с характерным блеском.
Пример 2. Если нагревать природную или водопроводную воду, то из нее задолго до кипения начнут выделяться пузырьки газа. Это — воздух, который был растворен в воде. Его растворимость в ней, как и любого газа, с повышением температуры уменьшается.
Пример 3. Неприятный запах в холодильнике исчезает, если в него поместить гранулы силикагеля — одного из соединений Силиция. Силикагель поглощает молекулы разных веществ без их разрушения. Аналогично действует активированный уголь в противогазе.
Пример 4. При превращении воды в пар теплота поглощается, а при замерзании воды — выделяется.
Чтобы определить, какое явление происходит — физическое или химическое, следует внимательно наблюдать за ним, а также тщательным образом исследовать вещества до и после проведения эксперимента.
Химические реакции в природе, повседневной жизни и их значение. В природе постоянно происходит огромное количество химических
реакций. Многие вещества, растворенные в реках, морях и океанах, взаимодействуют между собой, некоторые реагируют с кислородом. Растения поглощают из атмосферы углекислый газ, из почвы — воду с растворенными в ней веществами и превращают их в белки, жиры, глюкозу, крахмал, витамины, другие соединения, а также кислород. Очень важны реакции с участием кислорода, который поступает в живые организмы при дыхании.
Многие химические реакции сопровождают нас в быту. Они происходят во время жарки мяса, овощей, выпекания хлеба, прокисания молока, брожения плодовых и ягодных соков, отбеливания тканей, горения топлива, затвердения цемента и алебастра, почернения серебряных украшений и т. п.
Это интересно
Ежегодно в
растениях
образуется
150 млрд т
органических
веществ.
Химические реакции являются основой многих технологических процессов — получения металлов, производства синтетических волокон, лекарственных средств, удобрений, других важных веществ. Сжигая топливо, люди обеспечивают себя теплом и электрической энергией. С помощью химических реакций обезвреживают токсичные вещества, перерабатывают промышленные и бытовые отходы.
Однако некоторые химические реакции приводят к негативным последствиям. Ржавление железа сокращает срок работы различных механизмов, оборудования, транспортных средств, приводит к большим потерям этого металла. Пожары уничтожают жилье, промышленные и культурные объекты, исторические ценности, лесные массивы. Большинство пищевых продуктов портится вследствие их взаимодействия с кислородом воздуха. При этом образуются вещества, которые имеют неприятный запах, вкус, являются вредными для человека.
Химические свойства вещества. Каждому веществу присуща совокупность различных свойств.
Какие свойства вещества называют физическими? Приведите несколько соответствующих примеров.
Кроме физических свойств, вещества имеют и химические свойства. Среди них — способность вступать в химические реакции с определенными простыми и сложными веществами, инертность по отношению к другим веществам, термическая устойчивость или способность к химическому превращению при нагревании.
Рассмотрим некоторые химические свойства воды. В обычных условиях и при наличии воздуха (кислорода) она медленно взаимодействует с железом (этот процесс называют ржавлением). Но вода не реагирует с мелом, песком. Ее молекулы начинают разрушаться лишь при очень сильном нагревании (значительно выше 1000 °С). В результате этой химической реакции водяной пар превращается в два газа — водород и кислород.
Некоторые вещества (например, металл натрий, неметалл фтор) называют химически активными. Они взаимодействуют со многими веществами. Такие реакции нередко сопровождаются воспламенением или взрывом. Существуют и химически пассивные вещества. Золото ни при каких условиях не взаимодействует с водой, кислородом, уксусом, растворами питьевой и кальцинированной соды, а газ гелий вообще не вступает в химические реакции.
Химические свойства вещества зависят от его состава и внутреннего строения.
ВЫВОДЫ
Физическими явлениями называют явления, при которых каждое вещество сохраняется.
Химические явления, или химические реакции, — это превращения одних веществ в другие. Они могут сопровождаться разными внешними эффектами.
Множество химических реакций происходит в окружающей природе, живых организмах. На превращениях веществ основаны технологические процессы.
Химические свойства вещества заключаются в его способности вступать в определенные химические реакции.
125. Найдите соответствие:
Явление
1) взрыв динамита;
2) затвердевание расплавленного парафина;
3) подгорание пищи на сковороде;
4) образование соли при испарении морской воды;
5) расслоение интенсивно перемешанной смеси воды и растительного масла;
6) выцветание окрашенной ткани на солнце;
Тип явления
а) физическое явление;
б) химическое явление.
126. Какими внешними эффектами сопровождаются такие химические превращения:
а) горение спички;
б) ржавление железа;
в) брожение виноградного сока?
127. Как вы думаете, почему одни пищевые продукты (сахар, крахмал, уксус, соль) могут храниться неограниченное время, а другие (сыр, сливочное масло, молоко) быстро портятся?
128. Минерал малахит имеет сине-зеленый цвет, не растворяется в воде, при нагревании не плавится, а превращается в черное твердое вещество, выделяя углекислый газ и водяной пар. Какие свойства минерала являются физическими, а какие — химическими?
НА ДОСУГЕ
Изменение цвета при химической реакции
В два небольших стакана налейте немного воды и в каждый добавьте 1—2 капли спиртового раствора бриллиантового зеленого, известного под названием «зеленка». В один стакан добавьте несколько капель водного раствора аммиака (нашатырного спирта), в другой — раствора лимонной кислоты. Изменяется ли цвет жидкостей в стаканах? Если да, то как именно?
Результат опыта запишите в тетрадь и сделайте выводы.
ДОМАШНИЙ ЭКСПЕРИМЕНТ
Взаимодействие питьевой соды с лимонной кислотой,
соком квашеной капусты, кефиром
1. Приготовьте небольшие количества водных растворов лимонной кислоты и питьевой соды. Слейте вместе порции обоих растворов в отдельный стакан. Что происходит?
К остатку раствора лимонной кислоты добавьте немного порошка соды, а к остатку раствора соды — немного кристалликов лимонной кислоты. Какие эффекты наблюдаете — такие же, как при сливании растворов, или другие?
2. Налейте в один небольшой стакан немного сока квашеной капусты, а в другой — нежирного кефира или сыворотки. В оба стакана добавьте по 1/4 чайной ложки питьевой соды. Что наблюдаете?
Обнаруженные внешние эффекты обусловлены химическими реакциями.
ПРАКТИЧЕСКАЯ РАБОТА № 3 Исследование физических и химических явлений
Перед выполнением практической работы внимательно прочитайте правила работы и безопасности в химическом кабинете (с. 18, 29). Их необходимо строго соблюдать.
Будьте осторожны с огнем.
ОПЫТ 1
Насыпьте в пробирку небольшое количество медного купороса (вещество должно покрыть дно пробирки) и добавьте 3—4 мл воды. Содержимое пробирки перемешивайте стеклянной палочкой до полного растворения вещества. Одинаковый или разный цвет имеют медный купорос и его раствор?
Половину раствора перелейте в маленькую фарфоровую чашку и поставьте ее на кольцо лабораторного штатива. Зажгите спиртовку или сухое горючее и осторожно выпаривайте раствор до выделения из него первых кристалликов вещества. Сопоставьте их и медный купорос по цвету.
Какие физические явления происходили во время выполнения опыта? Произошло ли химическое явление? Ответ обоснуйте.
ОПЫТ 2
В пробирку со второй частью раствора медного купороса добавьте несколько железных стружек1. Какой цвет приобретает их поверхность? Какому металлу он свойственен?
Содержимое пробирки периодически перемешивайте стеклянной палочкой до полного изменения окраски раствора. Каков его окончательный цвет?
Медленно перелейте раствор в маленькую фарфоровую чашку (твердые вещества должны остаться в пробирке). Осторожно выпаривайте всю воду из раствора досуха2. Отличается ли по цвету твердый остаток от медного купороса? О чем это свидетельствует?
1 Вместо стружек можно взять железные кнопки, скрепки, гвозди.
2 Можно выпарить несколько капель раствора на предметном стекле.
Имело ли место химическое явление в опыте 2? Ответ обоснуйте.
Во время выполнения каждого опыта записывайте в таблицу свои действия, наблюдения, а после его завершения — выводы.
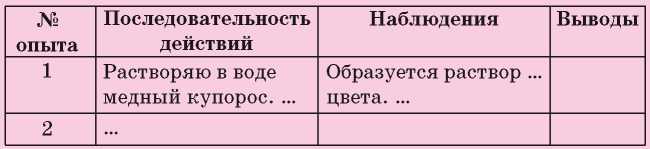
129. Происходили ли физические явления во время выполнения опыта 2? Если да, то какие?
130. Как можно с помощью магнита доказать, что в опыте 2 на поверхности железа образуется другой металл?
ДЛЯ ЛЮБОЗНАТЕЛЬНЫХ
Физические и химические явления
при выведении пятен
Появление пятна на одежде, скатерти — всегда неприятное событие. Как только замечаем пятно, сразу же думаем о том, как избавиться от него. Можно воспользоваться услугой специализированного предприятия либо попробовать вывести пятно самостоятельно.
Пятна от жира обычно удаляют органическим растворителем — бензином, петролейным эфиром, ацетоном. Свежее жирное пятно можно посыпать нагретым крахмалом, а затем его стряхнуть. Во время этих процедур происходят физические явления: в первом случае жир растворяется в жидкости и удаляется из ткани, а во втором — поглощается частицами крахмала. Некоторые нежирные пятна удается смыть водой.
Вывести пятна от ягод, овощей, напитков помогают средства^ бытовой химии. Они содержат вещества, которые реагируют с красителями и обесцвечивают их. Можно также применить сок лимона, растворы лимонной кислоты, гидроген пероксида (перекиси водорода), аммиака (нашатырный спирт), вступающие в реакции со многими окрашенными веществами.
Перед выведением пятна необходимо проверить, повредит ли ткань выбранное вами средство. Используя органический растворитель, следует помнить о том, что он огнеопасен.
Это материал учебника Химия за 7 класс Попель
Наступна сторінка: 18. Оксиген. Кислород