Попередня сторінка: 19. Схема химической реакции. Закон сох�...
Наступна сторінка: 21. Химические свойства кислорода:реак�...
Материал параграфа поможет вам:
- сравнить методы получения кислорода в промышленности и лаборатории;
- выяснить, что такое реакция разложения;
- узнать, как можно собрать кислород, образующийся во время опыта.
Открытие кислорода. Кислород был открыт во второй половине XVIII в. несколькими учеными разных стран. Первым получил этот газ шведский химик К. В. Шееле в 1772 г., а через два года, не зная об опытах предшественника, — английский химик Дж. Пристли. В 1775 г. французский ученый А. Л. Лавуазье исследовал кислород и дал ему название oxygen.
Кислород можно обнаружить с помощью тлеющей лучинки: помещенная в сосуд с этим газом, она ярко вспыхивает (рис. 53).

Рис. 53.
Обнаружение кислорода: а — тлеющая лучинка на воздухе; б — возгорание лучинки в кислороде
Промышленное получение кислорода.
Неисчерпаемым источником кислорода является воздух. Чтобы получить из него кислород, необходимо отделить этот газ от азота и других газов. На такой идее основан про-
мышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем температуру сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота равна -196 °С). Оставшаяся жидкость постепенно обогащается кислородом (температура кипения кислорода составляет -183 °С).
Жидкий кислород транспортируют в специальных стальных резервуарах с двойными стенками, между которыми создан вакуум (для эффективной теплоизоляции). Газообразным кислородом под высоким давлением наполняют баллоны; их окрашивают в голубой цвет (рис. 54).

Рис. 54.
Баллон с кислородом
Получение кислорода в лаборатории. В
лаборатории кислород получают с помощью химических реакций.
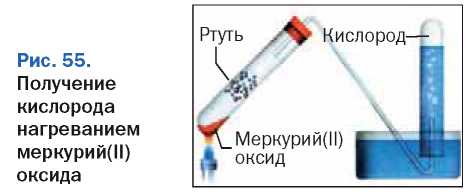
Дж. Пристли получил кислород из соединения, название которого — меркурий(П) оксид. Он нагревал вещество, фокусируя на нем солнечный свет с помощью стеклянной линзы.
В современном исполнении этот опыт изображен на рисунке 55. Желтый порошок мер-курий(11) оксида1 при нагревании превра-

щается в ртуть и кислород. Ртуть выделяется в газообразном состоянии и конденсируется на стенках пробирки в виде серебристых капель. Кислород накапливается во второй пробирке, предварительно заполненной водой.
Химическое уравнение этой реакции:
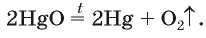
Ныне метод Пристли не применяют из-за токсичности паров ртути. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, протекают при нагревании.
Реакции, при которых из одного вещества образуется несколько других веществ, называют реакциями разложения.
Для получения кислорода в лаборатории чаще всего используют такие оксигенсодержа-щие соединения:
• калий перманганат KMnO4 (бытовое название — марганцовка; водный раствор вещества является дезинфицирующим средством)
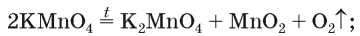
• калий хлорат KClO3 (тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала Х1Х в. К. Л. Бертолле)
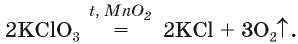
Чтобы разложение калий хлората происходило с выделением кислорода, к соединению добавляют небольшое количество манган(ГУ) оксида MnO2 (эта химическая формула записана над знаком равенства в химическом уравнении)1.

Вещество, которое вызывает реакцию или ускоряет ее, оставаясь после реакции неизменным, называют катализатором2.
Манган(ГУ) оксид в роли катализатора используют также при получении кислорода из водного раствора гидроген пероксида H2O2 (тривиальное название — перекись водорода). Если в этот раствор внести указанное соединение Мангана, начинается интенсивное выделение кислорода3. Реакция происходит в соответствии с уравнением
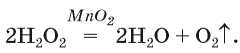
Кислород можно получить разложением натрий нитрата NaNO3 или калий нитрата KNO3. Эти соединения при нагревании сначала плавятся, а потом разлагаются:
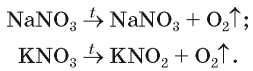
Преобразуйте схемы реакций в химические уравнения.
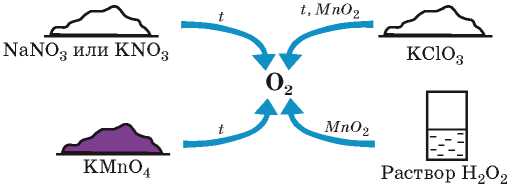
Сведения о том, как можно получить кислород в лаборатории, собраны в схеме 5.
Собирание кислорода в лаборатории. Образующийся кислород можно собирать двумя
способами — вытесняя им воду или воздух из сосуда.
Схема 5
Лабораторные методы получения кислорода
Первый способ основан на том, что кислород очень слабо растворяется в воде. Трубку, по которой идет газ, помещают под пробирку, наполненную водой (рис. 55, 56, а). Собранный таким способом кислород содержит примесь водяного пара.
Используя другой способ, учитывают, что кислород немного тяжелее воздуха. Трубку опускают в пустую пробирку или стакан до самого дна и накрывают отверстие сосуда стеклянной или пластмассовой пластинкой (рис. 56, б). Полноту наполнения сосуда кислородом проверяют тлеющей лучинкой.

Рис. 56.
Собирание кислорода: а — вытеснением воды; б — вытеснением воздуха
ВЫВОДЫ
Кислород был открыт в конце XVIII в. несколькими учеными.
В промышленности кислород получают из воздуха, а в лаборатории — с помощью реакций разложения некоторых оксигенсодержа-щих соединений.
Реакции, при которых из одного вещества образуется по меньшей мере два вещества, называют реакциями разложения.
В лаборатории кислород собирают вытеснением из сосуда воды или воздуха.
146. Как получают кислород в промышленности? Почему, на ваш взгляд, для этого не используют калий перманганат, гидроген пероксид?
147. Какие реакции называют реакциями разложения?
148. Преобразуйте в химические уравнения схемы реакций, одним из продуктов которых является кислород:
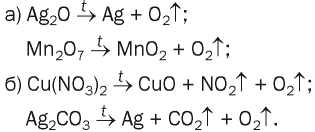
149. Что такое катализатор?
150. Какими способами можно собирать кислород, получаемый в лаборатории? На каких физических свойствах кислорода основан каждый способ? В каком случае визуально нельзя установить момент, когда сосуд полностью заполнен кислородом?
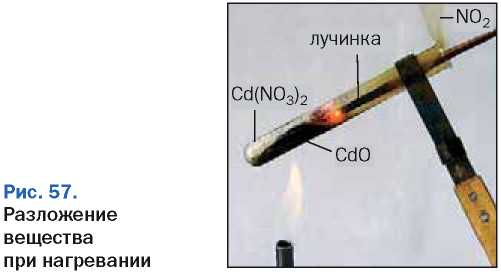
151. На рисунке 57 показано, как разлагается при нагревании белое твердое вещество — кадмий нитрат Cd(NO3)2. Внимательно рассмотрите рисунок и опишите, что происходит во время реакции. Почему загорается тлеющая лучинка? Составьте соответствующее химическое уравнение.
152. Массовая доля Оксигена в остатке после нагревания калий нитрата KNO3 составила 40 %. Полностью ли разложилось это соединение?
153. По материалам из интернета или других источников информации подготовьте небольшие сообщения о научных достижениях химиков К. В. Шееле, Дж. Пристли и К. Л. Бертолле.
ПРАКТИЧЕСКАЯ РАБОТА № 4 Получение кислорода разложением гидроген пероксида, собирание и подтверждение его наличия
Перед выполнением работы внимательно прочитайте правила работы и безопасности в химическом кабинете (с. 18, 29). Их необходимо строго соблюдать.
Будьте осторожны с огнем.
Сборка прибора. Прибор для получения газа состоит из пробирки и резиновой пробки с отверстием, в которое вставлена трубка (ее называют газоотводной). Соберите прибор (рис. 58). Для этого плотно закройте пробирку пробкой с газоотводной трубкой, как бы вкручивая пробку. Не прилагайте чрезмерных усилий, чтобы не треснуло стекло.
Проверка прибора на герметичность. В небольшой стакан налейте воды до половины объема. Конец газоотводной трубки погрузите в воду и согрейте пробирку

рукой (рис. 59). Если соединения пробирки, пробки и трубки герметичны, то через несколько секунд из трубки начнут выходить пузырьки воздуха. (Объем любого газа при повышении температуры возрастает.) Если воздух из трубки не выделяется, разъедините части прибора, а затем снова соедините их. Можно заменить пробирку или пробку с газоотводной трубкой на другие — большего или меньшего размера.
Получение и собирание кислорода. Разберите прибор. Налейте в пробирку (до 1/4—1/3 ее объема) раствор гидроген пероксида и добавьте к нему немного порошка манган(^) оксида. Что наблюдаете? Сразу закройте пробирку пробкой с газоотводной трубкой, поставьте в штатив для пробирок1, а конец трубки опустите ко дну другой пробирки (рис. 60).
Обнаружение кислорода. Зажгите спиртовку или сухое горючее, подожгите от пламени длинную лучинку и пригасите ее (как это делаем со спичкой), чтобы она тлела. С помощью лучинки убедитесь в том, что собранный газ — кислород.
1 Или закрепите пробирку вертикально в лабораторном штативе с помощью лапки.
После завершения эксперимента погасите лучинку, разберите прибор, вылейте содержимое пробирки в специальный сосуд и вымойте ее.
Названия этапов работы, наблюдения, выводы, а также уравнение реакции разложения гидроген пероксида запишите в таблицу:

154. Что произойдет с тлеющей лучинкой, если пробирка будет заполнена кислородом частично?
155. Как можно удалить собранный кислород из пробирки?
НА ДОСУГЕ
Каталитическое действие веществ, содержащихся в овощах, на разложение гидроген пероксида
Выполнив практическую работу № 4, вы убедились в том, что ман-ган(М) оксид является катализатором разложения гидроген пероксида. Предлагаем вам выяснить, содержатся ли в овощах вещества, которые также катализируют эту реакцию.
Подготовьте небольшие кусочки свежих овощей — картофеля, моркови, свеклы, черной редьки, корня сельдерея и др. Нанесите на каждый кусочек по 2—3 капли раствора гидроген пероксида (этот раствор можно приобрести в аптеке). Что наблюдаете? На каком образце (образцах) кислород выделяется наиболее интенсивно?
Проведите такой же эксперимент с отваренными кусочками овощей. Наблюдаете ли выделение газа? Если нет, то почему, по вашему мнению, получен иной результат?
Это материал учебника Химия за 7 класс Попель
Наступна сторінка: 21. Химические свойства кислорода:реак�...