Попередня сторінка: Виведення молекулярної формули речов�...
Наступна сторінка: Алкени й алкіни: гомологічні ряди, ізо�...
Пригадайте: формули для обчислення кількості речовини, використовуючи дані про масу або об'єм речовин.
Виведення молекулярної формули за даними про продукти згоряння речовин
Виведення молекулярної формули органічної сполуки — це один з перших етапів у дослідженні їх хімічної будови. Одним із способів, що почали використовувати хіміки для цього, стало дослідження продуктів згоряння або інших продуктів характерних реакцій — елементний аналіз. У цьому параграфі ми розглянемо саме такий алгоритм виведення молекулярних формул.
Цей алгоритм застосовують, якщо з умови задачі відомо:
• масу, або об’єм, або кількість речовини продуктів згоряння;
• загальну формулу класу сполук, або масові частки елементів у сполуці, або молярну масу, або відносну густину випарів.
Ви знаєте, що рівняння реакцій надають нам важливу інформацію про стехіометричні співвідношення кількостей речовини реагентів та продуктів реакції. Знаючи ці співвідношення, можна визначити склад речовини.
У загальному вигляді рівняння реакції горіння вуглеводнів можна записати так:
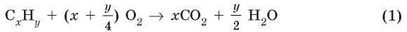
Знаючи кількості речовини продуктів згоряння, можемо визначити співвідношення атомів Карбону й Гідрогену у вуглеводні та встановити його емпіричну формулу.
Задача 1. Під час згоряння вуглеводню утворилися вуглекислий газ масою 13,2 г та вода масою 2,7 г. Відносна густина випарів вуглеводню за гелієм дорівнює 19,5. Визначте молекулярну формулу вуглеводню.
Розв’язання:
Під час розв’язування задач завжди зручніше мати справу з кількістю речовини, а не з масою або об’ємом. Тому першим кроком, як і для інших типів задач, буде розрахунок кількості речовини:
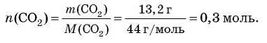

Записуємо умовну формулу вуглеводню СхНу. Співвідношення індексів дорівнює співвідношенню кількості речовини атомів Карбону та Гідрогену: x : y = n(C) : n(H).
В одній молекулі вуглекислого газу міститься один атом Карбону, отже, кількість речовини атомів Карбону у вуглеводні дорівнює кількості речовини утвореного вуглекислого газу n(C) = n(CO2) = 0,3 моль.
В одній молекулі води міститься два атоми Гідрогену, отже, у вуглеводні містилося атомів Гідрогену у два рази більше за кількість речовини води: n(H) = 2 ■ n(H2O) = 2 ■ 0,15 моль = 0,3 моль.
Співвідношення індексів: x : у = 0,3 : 0,3 = 1 : 1.
Отримуємо емпіричну формулу сполуки CH.
Для визначення молекулярної формули скористаємося відомою відносною густиною. Молярна маса вуглеводню:
M(CxHy) = M(He) ■ DHe(CxHy) = 4 г/моль ■ 19,5 = 78 г/моль.
Якби формула речовини була CH, то її молярна маса дорівнювала б 13 г/моль (12 + 1), що в шість разів менше за обчислену нами. Отже, помножуємо індекси на 6 і отримуємо молекулярну формулу C6H6.
Відповідь: формула сполуки — C6H6.
Задача 2. Під час згоряння органічної речовини масою 1,38 г утворилися вуглекислий газ масою 2,64 г та вода масою 1,62 г. Відносна густина випарів речовини за гелієм дорівнює 11,5. Визначте молекулярну формулу цієї речовини.
Розв’язання:
У цій задачі йдеться не про вуглеводень, а про якусь органічну речовину, яка може містити не тільки атоми C і H, а ще й атоми інших елементів. Оскільки в продуктах згоряння тільки вуглекислий газ та вода, то невідома речовина могла містити ще й Оксиген, і це треба перевірити.
Перевірка ґрунтується на законі збереження маси. Якщо сума мас атомів Карбону та Гідрогену дорівнюватиме масі початкової речовини, то інші елементи в ній відсутні. А якщо ні, то різниця у масах припадає на атоми інших елементів, у даному випадку, можливо, на Оксиген.
Обчислюємо маси атомів Карбону та Гідрогену за кількістю речовини:
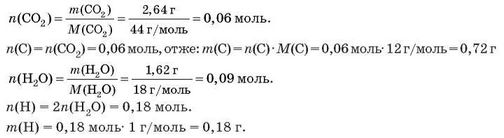
Сума мас атомів Карбону й Гідрогену: 0,72 г + 0,18 г = 0,9 г, що менше за початкову масу речовини. Тобто в органічній речовині ще міститься Оксиген масою: 1,38 г - 0,9 г = 0,48 г.
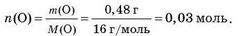
Визначити молекулярну формулу можна у два способи.
Спосіб I
Для сполуки із загальною формулою СхН O2 співвідношення індексів:
х у 2

Емпірична формула сполуки C2H6O, їй відповідає молярна маса М = 46 г/моль. Порівнюємо з молярною масою органічної сполуки:
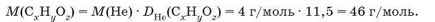
Молярні маси співпадають, отже, визначена емпірична формула є молекулярною.
Спосіб II
Визначимо кількість речовини органічної сполуки. Молярну масу обчислюємо за відносною густиною сполуки (46 г/моль), отже, кількість речовини:

Порівняємо кількість речовини невідомої сполуки з обчисленими вище кількостями речовини атомів: очевидно, що кількість речовини атомів Оксигену дорівнює кількості невідомої речовини, атомів Карбону — у 2 рази більше, а Гідрогену — у 6 разів. Отже, молекулярна формула C2H6O. Відповідь: формула сполуки — C2H6O.
Виведення молекулярної формули за даними про реагенти та продукти реакції
Цей алгоритм застосовують, якщо з умови задачі відомо:
• масу, або об’єм, або кількість речовини одного з реагентів;
• масу, або об’єм, або кількість речовини одного з продуктів реакції;
• у яких співвідношеннях відбувається реакція, тобто відомі стехіометричні коефіцієнти в рівнянні реакції.
Стехіометрія може допомогти визначити формулу невідомої речовини за результатами аналізу мас (або об’єму чи кількості речовини) реагентів та продуктів реакції для будь-якої хімічної взаємодії. Цей підхід ґрунтується на відомому співвідношенні кількості речовини в рівнянні реакції.
Задача 3. Під час бромування невідомого газуватого вуглеводню об’ємом 89,6 мл (н. у.) добуто монобромопохідну масою 0,38 г. Визначте вуглеводень.
Розв’язання:
Оскільки йдеться про вуглеводень, то його можна позначити СхНу або, простіше, R-H (літерою R позначають будь-який залишок молекули органічної речовини, атом чи групу атомів).
Оскільки відомо, що в результаті реакції утворилася моногалогенопохідна сполука, то в її формулі замість одного атома Гідрогену міститься атом Брому, і формулу продукту реакції позначимо R-Br.
За рівнянням реакції:
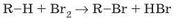
очевидно, що кількості речовини вуглеводню R-H та продукту реакції R-Br реакції однакові.
Кількість речовини вуглеводню дорівнює 0,0896 л / 22,4 л/моль =
= 0,004 моль. Оскільки кількість речовини продукту реакції така сама, то обчислюємо молярну масу продукту реакції:
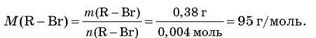
звідки визначаємо, що молярна маса R дорівнює:
M(R) = M(R-Br) - M(Br) = 95 - 80 = 15 г/моль.
Із такою молярною масою може бути тільки один вуглеводневий залишок —CH3, тоді невідомий вуглеводень — метан. Якщо молярна маса вуглеводневого залишку була б значно більшою і не було б інших відомостей про вуглеводень (загальна формула чи співвідношення атомів), то таку задачу розв’язати було б неможливо.
Відповідь: формула сполуки CH4.
Ключова ідея
Виведення молекулярної формули за відомими даними про масу або об'єм
реагентів хімічної реакції ґрунтується на стехіометричному співвідношенні
речовин.
Завдання для засвоєння матеріалу
114. Складіть у загальному вигляді рівняння реакцій горіння: а) алканів; б) алкенів; в) алкінів.
115. Укажіть число атомів Карбону, що містяться у складі однієї молекули алкану, на спалювання 3 л якого витрачається кисень об'ємом 15 л.
116. Для повного згоряння невідомого вуглеводню об'ємом 0,4 л витратили кисень об'ємом 1 л. Після закінчення реакції і приведення об'ємів газів до початкових умов об'єм газуватих продуктів становив 0,8 л. Визначте молекулярну формулу вуглеводню.
117. Визначте молекулярну формулу вуглеводню, під час згоряння якого отримали вуглекислий газ масою 6,6 г та воду масою 2,7 г. Відносна густина його випарів за воднем становить 42.
118. Під час згоряння вуглеводню кількістю речовини 0,05 моль утворилися вуглекислий газ та вода масами 11 г та 5,4 г відповідно. Установіть молекулярну формулу вуглеводню.
119. Визначте молекулярну формулу вуглеводню, якщо під час спалювання його кількістю речовини 0,1 моль утворюється вода масою 5,4 г і вуглекислий газ об'ємом 8,96 л (н. у.).
120. Під час спалювання вуглеводню масою 4,4 г отримали вуглекислий газ масою 13,2 г і воду масою 7,2 г. Відносна густина випарів цього вуглеводню за повітрям 1,517. Визначте молекулярну формулу вуглеводню.
121. Під час спалювання вуглеводню утворилися вуглекислий газ об'ємом 8,96 л (н. у.) та вода масою 7,2 г. Густина випарів вуглеводню 1,25 г/л. Визначте молекулярну формулу і вкажіть на особливості будови молекул речовин цього класу.
122. Під час згоряння вуглеводню кількістю речовини 0,1 моль отримали вуглекислий газ об'ємом 13,44 л (н. у.) та воду масою 12,6 г. Визначте молекулярну формулу вуглеводню.
123. Під час згоряння органічної речовини масою 2,175 г утворилися вуглекислий газ та вода масою 4,95 г та 2,025 г відповідно. Відносна густина випарів речовини за повітрям дорівнює 2. Визначте молекулярну формулу речовини.
124. Під час хлорування вуглеводню масою 1,44 г добуто дихлоропохідну речовину масою 2,82 г. Визначте вуглеводень.
125. Під час хлорування алкану масою 0,114 г добуто дихлоропохідну речовину масою 0,183 г. Визначте вуглеводень.
Це матеріал з підручника Хімія 10 клас Григорович
Наступна сторінка: Алкени й алкіни: гомологічні ряди, ізо�...