Попередня сторінка: Насичені одноосновні карбонові кисло�...
Наступна сторінка: Жири як клас хімічних сполук
Пригадайте:
• вплив водневого зв'язку на фізичні властивості спиртів, альдегідів та кислот (за § 14, 19, 21);
• назви карбонових кислот та їхніх залишків і ізомерію функціональної групи карбонових кислот (за § 20);
• оборотними реакціями називають реакції, які за одних і тих самих умов відбуваються як у прямому, так і у зворотному напрямках.
Поняття про естери
Естери — це похідні карбонових кислот із загальною формулою:
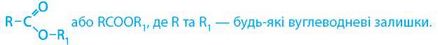
Характеристичну групу естерів -COO- називають естерною.
Як ви пам’ятаєте з § 20, естери є міжкласовими ізомерами карбонових кислот, отже, загальна молекулярна формула естерів така сама, як у кислот — CnH2nO2.
Естери: ізомерія та номенклатура
Як ви вже дізналися з попереднього параграфа, естери утворюються під час реакції естерифікації, що відбувається між карбоновими кислотами та спиртами.
Назви естерів походять від назв кислоти та спирту, з яких вони утворені:
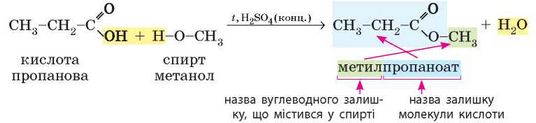
У назвах естерів часто використовують традиційні назви кислотних залишків (ацетат, бутират тощо). У нашому випадку метилпропаноат також можна назвати метилпропіонат. Часто використовують застарілі назви, для нашого прикладу — метиловий естер пропанової кислоти.
Окрім міжкласової ізомерії (§ 20) для естерів також характерна ізомерія карбонового ланцюга:
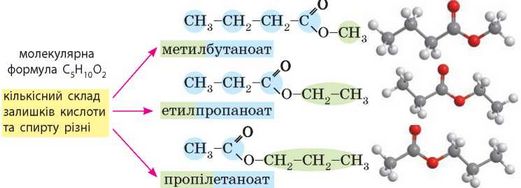
Естери: фізичні властивості та поширеність у природі
Фізичні властивості естерів зумовлені кількома чинниками:
• як і у вуглеводнів, у молекулах естерів переважають гідрофобні частини, внаслідок чого вони набагато гірше розчиняються у воді, ніж кислоти з таким самим складом;
• як і альдегіди, естери можуть утворювати водневі зв’язки за рахунок атома Оксигену в групі C=O, але ці зв’язки не настільки міцні внаслідок двох вуглеводневих залишків поряд.


Отже, молекули естерів здебільшого гідрофобні, не утворюють водневих зв’язків між собою і майже не утворюють їх з молекулами води.
Естери, утворені нижчими карбоновими кислотами:
• леткі безбарвні рідини, малорозчинні або практично нерозчинні у воді;
• багато таких естерів мають приємний запах, переважно фруктовий. Аромат багатьох квітів і плодів зумовлений наявністю саме естерів (мал. 22.1). Завдяки цьому естери застосовують у харчовій промисловості для приготування напоїв, цукерок, кондитерських виробів, фруктових есенцій, парфумів тощо;
• добре розчиняють неполярні органічні речовини, зокрема жири, завдяки чому їх застосовують для знежирення та як розчинники для
лаків, клеїв і фарб (мал. 22.2).

Естери, утворені вищими карбоновими кислотами:
• нелеткі, безбарвні, воскоподібні, тверді речовини;
• нерозчинні у воді, жирні на дотик.
Такі естери містяться у складі бджолиного воску.
Хімічні властивості естерів
Характерною хімічною властивістю естерів є гідроліз — реакція, зворотна до реакції естерифікації. За наявності каталізаторів естери взаємодіють з водою, перетворюючись
на кислоту і спирт. Залежно від середовища, в якому відбувається реакція (каталізатора), розрізняють два види гідролізу.
1. Кислотний гідроліз. Відбувається під час кип’ятіння естерів за наявності розбавленої сульфатної кислоти:
• у загальному вигляді:
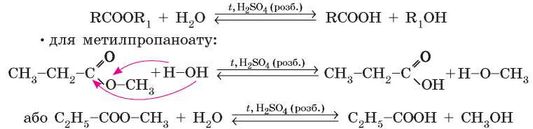
Оскільки сульфатна кислота є також каталізатором зворотної реакції — естерифікації, то реакція кислотного гідролізу є оборотною, отже, неможливо весь естер перетворити на продукти реакції.
2. Лужний гідроліз. Відбувається під час кип’ятіння естерів з розчинами лугів. Оскільки кислоти в лужному середовищі нейтралізуються, то продуктами реакції є сіль карбонової кислоти та спирт: • у загальному вигляді:
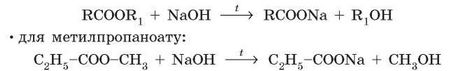
Лужний гідроліз необоротний, тому що утворюється не кислота, а її сіль. До того ж, луг не є каталізатором зворотної реакції (естерифікації). Реакцію лужного гідролізу естерів часто називають омиленням естерів.
Ключова ідея
Естери — функціональні похідні карбонових кислот з такою самою загальною формулою, як у кислот, але іншою структурною, що зумовлює принципову відмінність у фізичних властивостях.
Лінгвістична задача
Поясніть суть терміна «гідроліз», зважаючи, що грецькою hydro означає «вода», а lysis — «розкладання».
Контрольні запитання
332. Які речовини відносять до естерів?
333. Схарактеризуйте особливості складання назв естерів за систематичною номенклатурою.
334. Схарактеризуйте фізичні властивості естерів. Порівняйте їх з фізичними властивостями карбонових кислот та опишіть вплив водневого зв'язку.
335. Схарактеризуйте хімічні властивості естерів. Наведіть відповідні рівняння хімічних реакцій.
336. Яка реакція гідролізу естерів є оборотною, а яка — необоротною? Чому?
337. Схарактеризуйте поширеність естерів у природі та їх застосування.
Завдання для засвоєння матеріалу
338. Складіть формули таких естерів: а) метилетаноат; б) пропілпропано-ат; в) етилпропаноат; г) етилетаноат; д) метилпропаноат; е) метилме-таноат; є) етилметаноат.
339. Складіть структурні формули естерів за їх традиційними назвами: а) метилацетат; б) етилформіат; в) пропілпропіонат; г) метилбутират; д) етилвалерат.
341. Складіть назви естерів, структурні формули яких наведено на мал. 22.1.
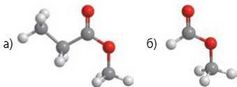
342. Складіть скорочені структурні формули та назви ес-терів за моделями молекул:
343. Естер, утворений етановою кислотою та бензиловим спиртом C6H5-CH2-OH, використовують для виробництва дешевих дезодорантів. Складіть рівняння реакції утворення цього естеру.
344. Складіть структурну формулу естеру, утвореного метиловим спиртом і метановою кислотою. Яка речовина іншого класу сполук має таку саму молекулярну формулу?
345. Складіть формули всіх можливих естерів, що можна добути, маючи в наявності метанол, етанол, пропанол, метанову, етанову та пропанову кислоти.
346. Складіть рівняння реакції лужного гідролізу: а) метилетаноату; б) етил-метаноату.
347. Складіть два рівняння реакцій, під час яких утворюються два різні естери, але з однаковою молекулярною формулою.
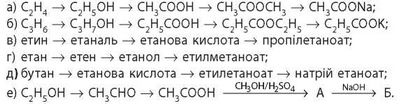
348. Складіть рівняння реакцій для здійснення перетворень за схемами:
Комплексні завдання
349. Обчисліть масу етилетаноату, що піддали омиленню, якщо в результаті одержали етанол масою 20,7 г.
350. Обчисліть маси кислоти та спирту, необхідних для одержання метил-етаноату масою 3,33 г.
351. Обчисліть масу метилетаноату, що можна одержати в реакції естери-фікації з етанової кислоти масою 3,6 г.
352. Під час лужного гідролізу пропілетаноату добуто натрій етаноат масою 229,6 г. Обчисліть масу естеру, що вступив у реакцію.
353. Метилетаноат масою 240,5 г добули за схемою: метан ^ етин ^ ета-наль ^ етанова кислота ^ метилетаноат. Визначте об'єм витраченого метану (н. у.).
354. Обчисліть масу етилетаноату, що можна добути зі 100 г оцтової есенції, яка містить 25 % води.
Завдання з розвитку критичного мислення
355. Порівняйте вплив водневих зв'язків на фізичні властивості естерів, карбонових кислот, альдегідів та спиртів.
356. Порівняйте фізичні властивості естерів, карбонових кислот, альдегідів, спиртів та вуглеводнів. Що в них є спільного, а чим вони відрізняються?
357. Які речовини утворюються при кип'ятінні етилметаноату з розчином калій гідроксиду? Чому в цій реакції не утворюється калій метанолят?
358. Проаналізуйте таблицю та дайте відповіді на запитання.
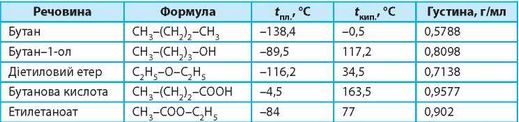
Як ви вважаєте, чому в таблиці для порівняння наведено: а) саме такі речовини; б) речовини саме цих класів сполук?
На прикладі наведених сполук схарактеризуйте відмінності в густині речовин.
Як впливає наявність подвійного зв'язку C=O на температури плавлення та кипіння речовин?
Яка основна причина відмінності температур плавлення етилетаноату та бутану?
Які дві пари ізомерів наведено в таблиці?
Як відрізнятиметься температура кипіння речовин (°С), якщо в молекулі бутану один атом Гідрогену кінцевого атома Карбону замінити на гідроксильну групу?
Для кожної пари речовин (із наведених у таблиці) поясніть причини відмінності в температурах кипіння.
Це матеріал з підручника Хімія 10 клас Григорович
Наступна сторінка: Жири як клас хімічних сполук