Попередня сторінка: Додатки та відповіді до підручника Хі�...
Наступна сторінка: Розподіл електронів в електронній обо...
Планетарна модель будови та склад атома
Сучасні уявлення про будову атома ґрунтуються на планетарній моделі атома, запропонованій Ернестом Резерфордом, за якою позитивно заряджене ядро оточене негативно зарядженими електронами (мал. 1.1).
Модель атома Резерфорда доповнив його учень Нільс Бор, який довів, що електрони можуть обертатися не на будь-якій орбіті, а тільки на певних відстанях від ядра, утворюючи концентричні сфери з електронів. Тому іноді планетарну модель атома називають моделлю Бора-Резерфорда.

Атом — це електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.

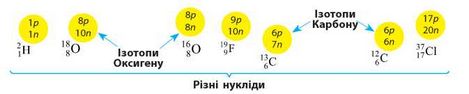
Нуклід — це різновид атомів із певним числом протонів і нейтронів У ядрі.
Нукліди позначають символом хімічного елемента із зазначенням протонного та масового чисел:

Хімічний елемент — це нукліди з однаковим зарядом ядра.
Протонів в атомах міститься таке число, що дорівнює порядковому номеру хімічного елемента в Періодичній системі. Отже, і заряд ядра також дорівнює порядковому номеру:
Порядковий номер елемента = число протонів у ядрі = заряд атома

Ізотопи — це різні нукліди одного хімічного елемента.
Ізотопами є нукліди, що мають однаковий заряд (протонне число) і різне нейтронне число:
Те, що атомне ядро має складну будову, було теоретично доведено на початку XX століття. Експериментально першими це довели англійські вчені Е. Волтон і Д. Кокрофт. Вони розщепили ядро атома Літію у квітні 1932 року.
Але лише п'ять місяців по тому 10 жовтня 1932 року цей експеримент блискуче повторили вчені А. К. Валь-тер, Г. Д. Латишев, О. І. Лейпунський,
К. Д. Синельников на базі Українського фізико-технічного інституту (зараз — Національний науковий центр «Харківський фізико-технічний інститут»). 10 жовтня 2002 року перед головним будинком ННЦ «ХФТІ» було відкрито пам'ятник на честь 70-річчя розщеплення атомного ядра.

Позитронна емісійна томографія (ПЕТ)
Позитрон — це античастинка електрона, тобто він має однакові з електроном характеристики, але, на відміну від електрона, має заряд +1. Позитронні випромінювачі використовують для вивчення функцій головного мозку методом позитронної емісійної томографії (ПЕТ). Перед дослідженням в організм уводять глюкозу, яка замість звичайних нуклідів Карбону 12C містить нуклід 11C. (Для одержання такої глюкози деякі овочі поміщають в атмосферу з умістом 11CO2. Рослини поглинають такий вуглекислий газ і використовують його для фотосинтезу, завдяки чому атоми 11C потрапляють до молекул глюкози.) Глюкоза потрапляє до мозку, який використовує її для живлення. Нукліди 11C із цієї глюкози випромінюють позитрони, що анігілюють з електронами в мозку, у результаті чого утворюються гамма-промені. Спеціальна техніка уловлює ці гамма-промені та будує карту мозку з позначенням зон ненормального засвоювання глюкози клітинами мозку. У такий спосіб досліджують функціонування мозку. Наприклад, технологія ПET-сканування продемонструвала, що поглинання глюкози мізками паліїв менше, ніж у непаліїв. Також цей метод дозволяє діагностувати маніакальну депресію, шизофренію, хворобу Альцгеймера тощо.
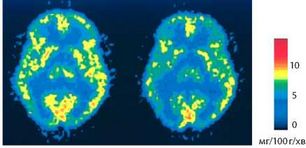
Результат позитронно-емісій-ної томографії дослідження активності мозку людини, яка не палить (ліворуч), та палія (праворуч). Показано помітне зниження швидкості метаболізму глюкози за наявності нікотину

Рух електрона в атомі. Орбіталі
• Для електрона можна визначити тільки ймовірність його перебування в певній точці простору навколо ядра. Ту частину електронної хмари, у якій електрон перебуває найбільше часу, називають атомною орбіталлю.
Орбіталь — це частина простору, де ймовірність перебування електрона вища за 90 %.
• Атомні орбіталі всіх електронів у атомі разом утворюють спільну електронну хмару атома — електронну оболонку.
• Серед орбіталей, що заповнюються електронами в атомі, виділяють чотири типи: s, р, d і f (мал. 1.2).
Структура електронної оболонки атомів
• В електронних оболонках атомні орбіталі утворюють чіткі структури, що різняться числом і типом орбіталей.
• Орбіталі з приблизно однаковою енергією утворюють енергетичні рівні (електронні шари), їх позначають числом n (n = 1, 2, 3, ...).
Кожний рівень із номером n містить п2 орбіталей.
• Кожна орбіталь може містити максимально два електрони, тому максимальна місткість енергетичного рівня 2n2.
Кожний рівень із номером n може містити максимум 2n2 електронів.
• Кожний енергетичний рівень складається з енергетичних підрівнів. Енергетичні підрівні об’єднують орбіталі одного типу (s, р, d і f), тому їх позначають так само, як і орбіталі.
Число енергетичних підрівнів на енергетичному рівні дорівнює
номеру цього рівня.

1923 року французький учений Луї де Бройль установив, що електрон через надзвичайно малі розміри має унікальні властивості: як і інші частинки, електрон має масу й заряд, але під час руху він виявляє хвильові властивості. Хвиля відрізняється від частинки тим, що не можна точно визначити її місце в просторі в певний момент часу. Через таку двоїсту природу — корпускулярно-хвильовий дуалізм — для електрона неможливо одночасно визначити швидкість руху та напрямок. Якщо ми знаємо, у кому напрямку рухається електрон, то не можемо визначити його швидкість руху, і навпаки. Цей принцип — принцип невизначеності — сформулював німецький учений В. Гейзенберг. Отже, для електрона поняття «траєкторія» застосовувати взагалі не слід. Про електрон можна стверджувати, що в певній точці простору є певна ймовірність його перебування.

Графічно орбіталь позначають квадратом. Отже, будова електронної оболонки на прикладі перших чотирьох енергетичних рівнів виглядатиме так:

Орбіталь — це ділянка простору, а не матеріальний об'єкт, тому торкнутися чи побачити її неможливо. Ті форми орбіталей, що наводять у різних джерелах, є результатом математичних розрахунків за рівнянням Шредінгера, яке описує поведінку електрона в електронній оболонці. Але на початку 2000-х років було сконструйовано аттосекундний лазер — лазер, що випромінює імпульси тривалістю в діапазоні кількох аттосекунд (1 аттосекунда = 1 · 10-18 с). Цей час порівнянний із часом одного обертання електрона навколо ядра атома. Це дає змогу зафіксувати положення електрона в атомі або молекулі в різні проміжки часу, тобто «сфотографувати» орбіталь. Цей ефект нагадує найімовірніші пози людей, що танцюють у темряві, в момент спалахів стробоскопа. Із використанням аттосекундно-го лазера вчені отримали зображення багатьох електронних орбіталей різних атомів і молекул. Ці дослідження блискуче підтвердили теоретичні розрахунки квантової фізики з форми атомних та молекулярних орбіталей середини XX століття.

Ключова ідея
Склад атома безпосередньо або опосередковано зашифровано в Періодичній
системі хімічних елементів.
Контрольні запитання
1. Як визначити: а) число протонів, нейтронів та електронів у атомі; б) максимальну місткість енергетичного рівня; в) число енергетичних рівнів, що заповнюються електронами в атомах певного елемента?
2. Схарактеризуйте структуру електронної оболонки атомів: склад енергетичних рівнів, склад і типи енергетичних підрівнів.
Завдання для засвоєння матеріалу
3. Складіть позначення нуклідів, якщо їхні ядра містять: а) р = 4, n = 4; б) р = 8, n = 9; в) р = 18, n = 20; г) р = 25, n = 30; д) р = 29, n = 34; е) р = 31, n = 41; є) р = 82, n = 123.
4. Визначте протонне та нейтронне числа нуклідів:

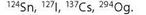
5. Визначте: а) нуклід Флуору з таким самим нейтронним числом, що в 17N; б) нуклід Калію з таким самим нейтронним числом, що в 20Ca; в) нуклід із нейтронним числом 35 і з таким самим протонним числом, що в 68Zn?
6. Із наведеного переліку

виберіть: а) ізотопи; б) нукліди з однаковим нейтронним числом; в) нукліди з однаковим нуклонним числом.
Завдання з розвитку критичного мислення
7. Ґрунтуючись на значенні відносної атомної маси хімічних елементів, спро-гнозуйте, у вигляді яких нуклідів існують у природі: а) Літій; б) Бор; в) Карбон; г) Натрій; д) Фосфор; е) Купрум.
8. Як ви розумієте твердження, що «електрон одночасно виявляє властивості і частинки, і хвилі»? Як ця властивість електрона позначається на особливостях будови атома?
9. Чому терміни «енергетичний рівень» та «електронний шар» є синонімами? Міні-проекти
10. Використовуючи додаткові джерела інформації, проаналізуйте експеримент Резерфорда з визначення будови атома. Які результати цього досліду дозволили йому зробити висновки про планетарну будову атома?
11. Використовуючи додаткові джерела інформації, схарактеризуйте значення постулатів Бора для формування сучасної моделі будови атома.
12. зверніться до додаткових джерел інформації та поясніть, чому атомні ор-біталі мають саме таку форму. Чим, на вашу думку, це зумовлене?
Це матеріал з підручника Хімія 11 клас Григорович
Наступна сторінка: Розподіл електронів в електронній обо...