Попередня сторінка: Повторення основних понять про будову...
Наступна сторінка: Особливості будови атомів у збудженом...
Пригадайте: розташування s-, p-, d- та /-елементів у Періодичній системі (див. форзац).
Місткість орбіталей
На кожній орбіталі максимально можуть розміститися два електрони, що мають однакову енергію, але які відрізняються особливою властивістю — спіном.
Спін електрона — це його внутрішня властивість, що характеризує відношення електрона до магнітного поля. Наочно цю властивість можна уявити, як можливість обертання електрона навколо своєї осі (мал. 2.1).
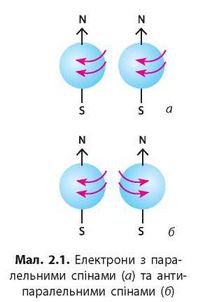

Одна орбіталь може містити лише два такі електрони, спіни яких є антипаралельними. Це правило називають принципом заборони Паулі:
На одній орбіталі можуть перебувати не більш ніж два електрони, причому їхні спіни мають бути антипаралельними.

Розподіл електронів по орбіталях.
Принцип «мінімальної енергії»
Електрони займають орбіталі послідовно, починаючи з першого енергетичного рівня, за порядком збільшення енергії рівня та підрівня. Спочатку «заселяється» перший енергетичний рівень, потім — другий, третій тощо. Цей принцип називають принципом найменшої енергії:
В атомі кожний електрон намагається зайняти орбіталь із мінімальним значенням енергії, що відповідає найміцнішому його зв'язку з ядром.
Порівнювати енергії підрівнів слід з урахуванням такого:
- енергія s-підрівня завжди менша за енергію р-підрівня того самого енергетичного рівня, тобто s-підрівень заповнюється електронами раніше за р-підрівень;
- енергія d-підрівня більша навіть за енергію s-підрівня наступного енергетичного рівня.
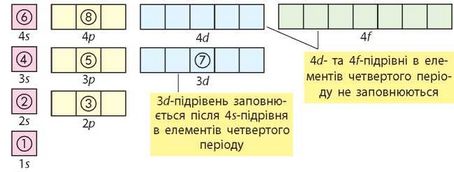
Порівняти енергію різних електронних підрівнів можна за допомогою суми двох чисел (п + /). Число п — це номер енергетичного рівня, на якому перебувають орбіталі, а / — це число, що відповідає енергетичному під-рівню (типу орбіталі). Так, для s-орбіталей / = 0, для р-орбіталей / = 1, для d-орбіталей / = 2, для /-орбіталей / = 3. згідно з правилом Клечковського, підрівні заповнюються електронами за порядком збільшення суми (n + /). Якщо для двох підрівнів ця сума однакова, то заповнюється той підрівень, що перебуває на ближчому до ядра електронному рівні. Так, для 4s-підрівня сума (п + /) дорівнює 4 + 0 = 4, а для 3а,-підрівня сума (п + /) дорівнює 3 + 2 = 5. Отже, енергія 4s-підрівня менша, ніж у 3^-підрівня, тому 4s^^-рівень заповнюється раніше. У такий спосіб можна порівнювати енергії будь-яких енергетичних підрівнів.
Порядок заповнення електронами енергетичних підрівнів можна ілюструвати так:
У разі, якщо підрівень складається з кількох орбіталей та містить більше одного електрона, то за можливості електрони займають вільні орбіталі, а за відсутності вільної — утворюють пару з іншим електроном у напівзаповненій орбіталі. Це правило називають правилом Хунда:
На одному енергетичному підрівні електрони розподіляються по орбіталях таким чином, щоб число неспарених електронів було максимальним.

Фрідріх Хунд своє правило сформулював в інший спосіб, як-от у межах одного підрівня електрони розташовуються в такий спосіб, щоб сумарний спін був максимальний. У разі розташування електронів на одному підрівні так
сумарний
спін дорівнює +1, а якщо два електрони на орбіталі утворять електронну пару
то сумарний спін дорівнює нулю. Отже, правильним є перший варіант заповнення.
Електронні та графічні формули атомів s-, p-, d-елементів
Розподіл електронів по орбіталях в атомах s- та ^-елементів перших трьох періодів ви вже вивчали у 8 класі. Пригадаємо основні принципи:
• число енергетичних рівнів, що заповнюються в атомі певного елемента, визначають за номером періоду Періодичної системи, у якому розташований цей хімічний елемент;
• число електронів на зовнішньому енергетичному рівні s- та ^-елементів дорівнює номеру групи Періодичної системи, у якій розміщений елемент (за коротким варіантом), окрім Гелію;
• в атомах s-елементів останньою заповнюється електронами орбі-таль s-підрівня, в атомів ^-елементів — орбіталі ^-підрівня тощо.
В атомів Гелію (1 період, VIIIA група, № 2) в електронній оболонці міститься два електрони, які перебувають на першому енергетичному рівні на єдиній s-орбіталі (s-елемент):

Атоми Літію (2 період, ІА група, № 3) містять три електрони: перший рівень вміщує два електрони, а на другому міститься тільки один електрон на 2s-орбіталі (s-елемент):

В атомів Бору (2 період, ІІІА група, № 5) в електронній оболонці 5 електронів, їх вистачає для заповнення 1s- та 2s-орбіталей, і ще один з’являється на 2р-орбіталі (р-елемент):

В атомів Натрію (3 період, ІА група, № 11) заповнюється три енергетичних рівні, останньою — 3s-орбіталь (s-елемент):
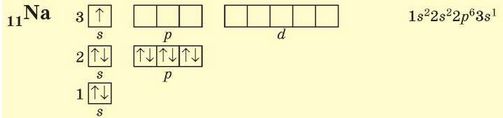
В атомах Аргону (3 період, VIIIA група, № 18) — останнього елемента третього періоду — повністю зайняті всі s- і р-орбіталі, останнім заповнювався р-підрівень (р-елемент):
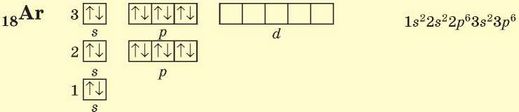
В атомах Калію (4 період, ІА група, № 19) заповнюється чотири енергетичних рівні, останньою — 4в-орбіталь (s-елемент). Оскільки енергія 4з-підрівня менша за енергію 3^-підрівня, то остання лишається вільною:
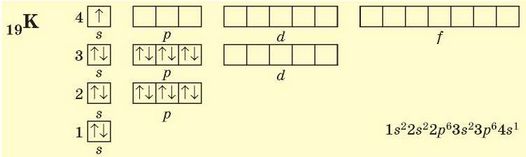
Скандій (4 період, ІІІВ група, № 21) — перший d-елемент 4 періоду. У його атомах 4s-підрівень заповнений повністю, а останніми заповнюються 3^-орбіталі:
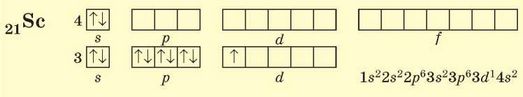
Для d-елементів електронну формулу складають по-різному:

Ферум (4 період, VIIIB група, № 26) розташований приблизно посередині d-елементів 4 періоду, його 3d-підрівень містить 6 електронів:
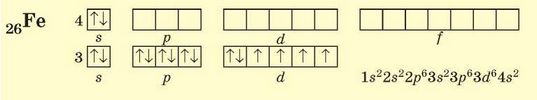
Отже, принципи, що ми розглянули, допоможуть вам зрозуміти будову електронних оболонок майже будь-яких атомів. Ці принципи є універсальними і виконуються для всіх елементів.
Ядерний магнітний резонанс
Спін — властивість частинки, що характеризує її здатність взаємодіяти з магнітним полем. Спін властивий не тільки електронам, а й багатьом субатомним частинкам, зокрема й багатьом ядрам, які називають магнітними ядрами. за наявності потужного зовнішнього магнітного поля магнітні ядра здатні поглинати енергію. Це явище називають ядерним магнітним резонансом — ЯМР (відкрили Ф. Блох та Е. М. Парсел, Нобелівська премія 1952 року). залежно від електронної густини, ядра атомів поглинають різну енергію, що дозволяє розрізнити хімічне оточення атомів у молекулі. Метод ЯМР сприяв розвитку органічної хімії, оскільки дозволив дуже швидко визначати хімічну будову речовин.
Понад 30 років ядерний резонанс використовують у медицині для діагностики захворювань методом магнітної резонансної томографії (МРТ). Цей метод дозволяє отримати детальні зображення будь-якого органа людини, судин або кісток і навіть побудувати їхні тривимірні зображення. Метод МРТ значно полегшив діагностику багатьох захворювань, а також підготовку до оперативного втручання.

Ключова ідея
Головний принцип, що регулює порядок заповнення орбіталей електронами, — принцип найменшої енергії. згідно з ним, енергетичні підрівні в атомі заповнюються електронами в такому порядку:
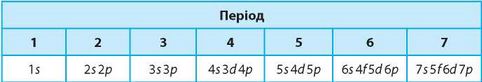
Контрольні запитання
13. Скільки електронів може максимально перебувати на: а) одній атомній орбіталі; б) s-підрівні; в) р-підрівні; г) d-підрівні?
14. Дайте визначення принципу найменшої енергії, правила Хунда, принципу Паулі. Схарактеризуйте їхнє значення для визначення розподілу електронів в електронній оболонці.
15. Що називають «неспареним електроном», «електронною парою»?
16. Чому перший енергетичний рівень заповнюється раніше за другий?
17. Наведіть порядок заповнення електронами підрівнів для перших чотирьох енергетичних рівнів.
18. Чому в атомах Берилію електрони другого енергетичного рівня перебувають на s-орбіталі, а не на р-орбіталі?
19. Скільки енергетичних рівнів зайнято електронами в атомах: а) Натрію; б) Кальцію; в) Брому?
Завдання для засвоєння матеріалу
20. Складіть графічну електронну формулу Нітрогену, Флуору, Магнію, Алюмінію, Силіцію та Феруму. Визначте число електронних пар та неспарених електронів на зовнішньому енергетичному рівні.
21. Назвіть два хімічні елементи, в атомах яких на зовнішньому енергетичному рівні відсутні: а) вільні орбіталі; б) місця для приєднання електронів.
22. Атоми якого хімічного елемента другого періоду містять таке саме число неспарених електронів, як атоми: а) Літію, б) Нітрогену; в) Берилію?
23. Складіть графічні електронні формули: а) Нітрогену і Фосфору; б) Окси-гену і Сульфуру; в) Флуору і Хлору. Що спільного в будові електронних оболонок цих атомів і чим вони відрізняються?
24. У яких хімічних елементів заповнюється електронами: а) 2s-підрівень; б) 2р-підрівень; в) 3s-підрівень; г) 3р-підрівень; д) 4s-підрівень; е) 3а,-підрівень?
25. Визначте елемент з електронною формулою зовнішнього енергетичного
рівня: а) 1s2; б) 2s1; в) 2s22p3; г) 3s23p4; д) 4s2; е) 3d4s2; є) 3d64s2.
26. Атоми якого елемента третього періоду містять найбільше: а) електронів; б) неспарених електронів; в) електронних пар?
27. Який енергетичний підрівень заповнюється останнім: а) у s-елементів четвертого періоду; б) р-елементів п'ятого періоду; в) s-елементів третього періоду; г) p-елементів другого періоду; д) d-елементів третього період у?
Це матеріал з підручника Хімія 11 клас Григорович
Наступна сторінка: Особливості будови атомів у збудженом...