Попередня сторінка: 6. Akovalens kötés. Molekuláris és atomrács-szerkezetű anyagok
Наступна сторінка: 8. Kristályos és amorf anyagok
E téma tananyaga segít nektek:
feleleveníteni a hidrogénkötés fogalmát és kialakulását;
megismerni a fémes kötést; megérteni a hidrogénkötés és a fémes kötés hatását az anyagok tulajdonságaira.
A hidrogénkötés. Ezzel a molekulák között kialakuló kémiai kötéssel a 9. osztályban ismerkedtetek meg, amikor a víz szerkezetét és tulajdonságait tanultátok. A vízmolekulát alkotó atomok közül az oxigénatom magja vonzza jobban a kötő elektronpárt így a közös elektronpár eltolódik az elektronegatívabb elem, az oxigénatom felé. Ezen az atomon kialakul egy rész-leges negatív töltés (kisebb, mint az elektron töltése), a két hidrogénatomon pedig részleges pozitív töltés:
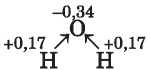
A vízmolekulák úgy rendeződnek egymáshoz, hogy a molekulát alkotó atomok ellentétes töltéseikkel kapcsolódjanak.
A hidrogénatomok részvételével létrejövő molekulák közötti elektrosztatikus kölcsönhatást hidrogénkötésnek nevezzük.
A hidrogénkötés az égjük molekula hidrogénatomjának és a másik molekula nagy elektronega-tivitású atomjának - fluor, oxigén vagy nitrogén nem kötő elektronpárja között jön létre. Elfogadott jelölése: három pont a kötést alakító atomok között. Ez gyenge kölcsönhatás, ami az anyag cseppfolyós halmazállapotában állandóan felbomlik és újraalakul más molekulák között (9. ábra).
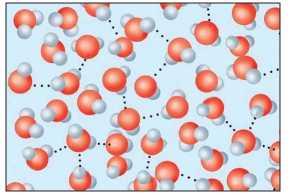
9. ábra
Hidrogénkötés a vízmolekulák között
Rajzoljátok fel a három hidrogén-fluorid molekula közötti hidrogénkötést.
Hidrogénkötés található a szervetlen savakban, alkoholokban, karbonsavakban és más, hidrogént tartalmazó molekuláris vegyületben. Olykor ez a kötés molekulán belül is kialakul. Ennek köszönhető a fehérje globulába való alakulása.
A hidrogénkötés nem feltétlenül egyforma molekulák között jön létre. Majdnem minden szervetlen sav, valamint a kis molekulatömegű alkoholok és szerves savak vízben való oldódásánál hidrogénkötés alakul ki a vegyidet és a víz molekulái között. Másfelől, a szén-hidrogének, az éterek a vízben gyakorlatilag nem oldódnak, mivel vegyületeikben a hidrogén nem erősen elektronegatív atomhoz kapcsolódik, így a bennük található kovalens kötés polaritása elenyésző.
A hidrogénkötést tartalmazó vegyületekben a moláris tömeg alapján a várhatónál sokkal magasabb az olvadás- és a forráspont. Hasonlítsunk össze két majdnem azonos moláris tömegű vegyületet: a víz
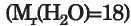
közönséges körülmények között csepp
folyós halmazállapotú, a metán
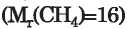
pedig
ugyanüyen körülmények között gáz. Ezt a vízmolekulák között fellépő erős hidrogénkötés magyarázza. Ha nem lenne a molekulák között hidrogénkötés, akkor a víz földi körülmények között gáz halmazállapotú lenne.
Érdekes
tudnivaló
Avizes oldatokban végbemenő anionok hidratá-ciója a hidrogénkötés kialakulásának köszönhető, ami az ion és a vízmolekula között képződik:
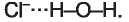
A fémes kötés. A fémek nagyon jól vezetik az elektromos áramot. Fizikából tanultátok, hogy ha a fémekre feszültséget kapcsolunk, akkor az elektromos mező hatására az elektronok mozgása rendezetté válik. Az elektromos áram vezetésének feltétele, hogy szabadon képes elmozdulni, töltéssel rendelkező részecskéket tartalmazzon. Ez a fémek esetében adva van: a fématomok kevés számú vegyértékelektronja az atommagtól viszonylag távol van, lazán kötött, és a nemfémektől eltérően, könnyen leadja azokat. Ezért a fématomok pozitív töltésű ionokká alakulnak.
Ha sok fématom kerül egymáshoz közel, az atomokról levált elektronok viszonylag szabadon elmozdulnak a fém-kationok között. Vagyis pozitív töltésű fématom-törzsek és egy delokalizált1 (helyhez nem kötött) elektronrendszer jön létre. Annak ellenére, hogy a fémben kationok
és szabad elektronok jelennek meg, a fém, még nagyon kis mennyiségben is elektromosan semleges (10. ábra).
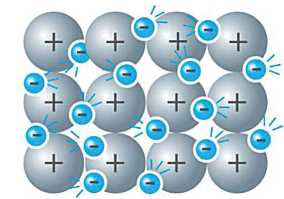
10. ábra
A fémek
szerkezetének
modellje
A pozitív töltésű fématom-törzsek és a delokalizált elektronok közötti vonzóerőt fémes kötésnek nevezzük.
A delokalizált elektronok elmozdulásával a fémeknek nem csak jó elektromos-, hanem jó hővezetésük is magyarázható. A fémes kötésnek köszönhető a jellegzetes fémes csillogás is. A fémek többsége kalapálható, megmunkálható. Ütésre, nyomásra, húzásra a fémrács síkja bármely irányban elcsúsztatható, eközben a fémes kötés (a delokalizált elektronok mozgása) nem változik.
ÖSSZEFOGLALÁS
A hidrogénkötés a molekulák közötti elektrosztatikus kölcsönhatás, ami a hidrogénatomok részvételével történik. A hidrogénkötés kialakulásához egy nagy elektronegativitású, kisméretű és nem kötő elektronpárral rendelkező elem atomja szükséges, amelyhez közvetlenül kapcsolódik egy hidrogénatom. Hidrogénkötés található a vízben, az alkoholban, a savakban és egyéb vegyületékben, valamint oldataikban. Ez másodrendű kötés, amely hatással van az anyag fizikai tulajdonságaira.
A fémes kötés a fém-kationok és a delokalizált elektronok közötti kölcsönhatás. Ez a szerkezet magyarázza a fémek tulajdonságait: jó elektromos- és hővezetés, fémes csillogás, megmunkál-hatóság.
56. Az alábbi molekulák közül melyik esetben alakul ki hidrogénkötés: CO2, NH3, SCl4, CH3OH, H2SO4, H2, O3?
57. A fehérjemolekulában milyen elemek között alakulhat ki hidrogénkötés?
58. Fontoljátok meg a metánsav-molekula és a vízmolekula közötti hidrogénkötések kialakulásának lehetőségeit. Rajzoljátok fel a molekulák szerkezeti képletével ezeket a kötéseket.
59. Hogyan magyarázható az a tény, hogy az etán közönséges körülmények között gáz halmazállapotú, a metanol pedig cseppfolyós, miközben moláris tömegük közel azonos?
60. A fémekben az elektronok kaotikusán mozognak. Milyen esetben válik rendezetté az elektronok mozgása, mi történik ekkor?
61. írjátok fel a fémrácsban található (10. ábra) alkáli- és az alkáli földfémek kationjainak általános elektronszerkezeti képletét.
62. Fogalmazzátok meg, szerintetek miért nem alakul ki fémes kötés a nemfémes anyagokban?
63. Milyen nemfémet ismertek, ami vezeti az elektromos áramot?
Ez a tankönyv anyaga Kémia a 11. osztály számára Pavlo Popéi
Наступна сторінка: 8. Kristályos és amorf anyagok