Попередня сторінка: 15. Многоатомные спирты. Глицерол
Наступна сторінка: 17. Альдегиды
Материал параграфа поможет вам:
- ознакомиться с веществом, которое называют фенолом;
- сравнить строение молекул фенола и спиртов;
- узнать о свойствах фенола, его физиологическом действии и влиянии на окружающую среду.
Это интересно
Впервые фенол был выделен из каменноугольной смолы в 1834 г.
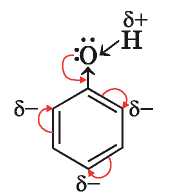
Органическое соединение, название которого — фенол, а химическая формула — C6H5OH, по составу напоминает одноатомный спирт. Но это вещество не относят к классу спиртов, поскольку гидроксильная группа в его молекуле непосредственно связана с бензеновым кольцом (рис. 37):
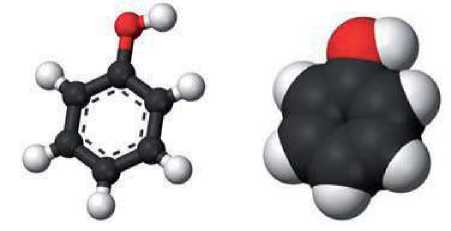
Рис. 37.
Модели
молекулы
фенола
Строение молекулы. Наличие бензенового кольца в молекуле фенола C6H5OH обуславли
вает большую подвижность атома Гидрогена в ОН-группе, чем в молекулах одноатомных спиртов ДОН. Если в молекуле спирта углеводородный заместитель отдает часть своей электронной плотности атому Оксигена (CH3-»ОН), что приводит к уменьшению полярности связи О-Н, то в молекуле фенола наоборот — атом Оксигена «обогащает» электронной плотностью бензеновое кольцо
Неподеленная пара р-электронов атома Оксигена, «втягиваясь» в кольцо, образует с р-электронами атомов Карбона общую электронную систему (рис. 38). Длина связи C-O уменьшается, и она становится прочнее.
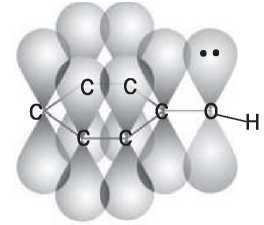
Рис. 38.
Перекрывание р-орбиталей в молекуле фенола
Атом Оксигена, компенсируя потерю электронной плотности, сильнее смещает в свою сторону общую с атомом Гидрогена электронную пару

Полярность связи

возрастает; атом Гидрогена в молекуле фенола приобретает больший положительный заряд, чем в молекуле спирта, становится подвижнее и поэтому легче замещается на другие атомы в химических реакциях.
Гидроксильная группа также влияет на бензеновое кольцо. Она вызывает повышенную подвижность атомов Гидрогена бензено-вого кольца у двух ближайших и самого отдаленного атомов Карбона1, где сосредоточивается наибольшая электронная плотность:

Физические свойства. Фенол — твердое бесцветное вещество со специфическим «карболовым» запахом. На воздухе соединение постепенно окисляется и со временем приобретает бледно-розовый цвет (рис. 39).
Рис. 39.
Фенол
Фенол умеренно растворяется в холодной воде и неограниченно — в горячей.
Температуры плавления и кипения фенола (+41 и +182 °С соответственно) выше, чем бен-зена (с. 66). Причиной этого является образование водородных связей между молекулами фенола с участием атомов Гидрогена и Оксиге-на гидроксильных групп.
Химические свойства. Фенол — химически активное вещество; его реакционную способность обуславливают и гидроксильная группа, и бензеновое кольцо.
Реакции с участием гидроксильной группы. В отличие от спиртов фенол проявляет кислотные свойства (раньше фенол называли карболовой кислотой). Однако вещество диссоциирует в растворе очень слабо
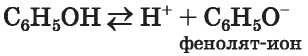
и не изменяет окраски индикаторов.
Реакции с металлами. Фенол, нагретый до начала плавления, взаимодействует со щелочными металлами с выделением водорода (рис. 40) и образованием солей:
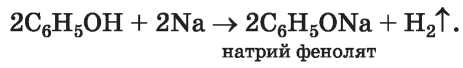

Рис. 40.
Реакция фенола с натрием
Реакции со щелочами. Фенол как слабая кислота реагирует с водными растворами щелочей:
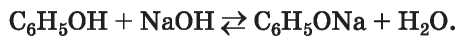
Такие реакции являются обратимыми; феноляты частично взаимодействуют с водой (их растворы имеют щелочную среду).
При добавлении раствора феррум(Ш) хлорида к раствору фенола появляется фиолетовое окрашивание (рис. 41). Это — качественная реакция на фенол. Спирты не взаимодействуют с феррум(Ш) хлоридом.

Рис. 41.
Реакция фенола с феррум(Ш) хлоридом
Реакции замещения атомов Гидрогена в бензеновом кольце. Гидроксильная группа активирует бензеновое кольцо и способствует замещению атомов Гидрогена у атомов Карбона с повышенной электронной плотностью.
Реакции с галогенами. В отличие от бензена фенол быстро и без катализатора взаимодействует с галогенами1. Это вещество, в частности, реагирует с водным раствором брома. Бромная вода обесцвечивается, и образуется белый осадок (рис. 42). При этом на атомы галогена замещаются все подвижные атомы Гидрогена в бензеновом кольце2:

Эта реакция является качественной на фенол.

Рис. 42.
Реакция фенола с бромной водой
Таким образом, взаимное влияние бензено-вого кольца и гидроксильной группы в молекуле фенола обуславливает кислотные свойства вещества и облегчает протекание реакций
замещения в бензеновом кольце (по сравнению с бензеном).
Получение и применение. Важнейшим источником фенола является каменноугольная смола. Его также получают из продуктов переработки нефти — бензена и пропена.
Фенол используют в производстве феноло-формальдегидных смол (с. 199), красителей, взрывчатых веществ, пестицидов.
Это интересно
Два остатка молекулы фенола имеются в молекуле фенолфталеина.
Физиологическое действие. Фенол очень токсичен. Он вызывает нарушения нервной системы, ожоги кожи, отрицательно влияет на кишечно-желудочный тракт, органы дыхания. При постоянном воздействии малых количеств фенола возникают головная боль и усиленное сердцебиение, нарушается сон, поражаются печень и почки. Существуют жесткие ограничения, касающиеся содержания фенола в воде, используемой в быту: в 1 л воды не должно быть более 0,001 мг этого вещества.
Загрязнение фенолом окружающей среды. Источниками поступления фенола в окружающую среду являются коксохимические заводы, предприятия по производству фенолофор-мальдегидных смол, сухой перегонке древесины. Попадая вместе с газовыми выбросами в атмосферу и со сточными водами в водоемы, фенол наносит серьезный вред растительному и животному миру. Очистка промышленных стоков от фенола является одной из важных технологических задач.
ВЫВОДЫ
Фенол C6H5OH — производное бензена, в молекуле которого вместо атома Гидрогена имеется гидроксильная группа. Вещество не относят к спиртам.
Фенол — твердое бесцветное вещество с характерным запахом, неограниченно раство-
римое в горячей воде. Это соединение взаимодействует со щелочными металлами, щелочами, бромной водой.
Фенол получают из углеводородного сырья. Его используют в производстве органических веществ, пластмасс.
Фенол очень токсичен.
114. Почему фенол, в отличие от этанола, проявляет кислотные свойства?
115. Как влияет бензеновое кольцо на полярность связи O-H в молекуле фенола?
116. По материалам из интернета или других источников информации подготовьте сообщение о том, какие производства могут загрязнять окружающую среду фенолом.
117. Составьте уравнения реакций фенола с литием, калий гидроксидом и назовите образующиеся соединения.
118. Какой объем водорода (н. у.) выделится в результате взаимодействия 2,3 г натрия с избытком фенола?
119. Массовые доли Карбона и Оксигена в ароматическом органическом соединении равны 76,6 и 17,0 % соответственно, а относительная молекулярная масса — 94. Определите формулу вещества.
Это материал учебника Химия 10 класс Попель, Крикля
Наступна сторінка: 17. Альдегиды