Попередня сторінка: 19. Насыщенные одноосновные карбоновые...
Наступна сторінка: 21. Эстеры
Материал параграфа поможет вам:
- вычислять количество вещества, массу или объем продукта реакции с использованием сведений о содержании примесей в реагенте;
- определять массовую долю примесей в реагенте по известным количествам вещества, массам или объемам реагента и продукта реакции.
Вы знаете, что абсолютно чистых веществ не бывает. Не только природные вещества, но и полученные на заводах, в лабораториях содержат посторонние вещества, или примеси. В незначительном количестве примеси имеются в химических реактивах; они попадают при производстве реактивов, их хранении, использовании (рис. 51). Поэтому перед проведением химической реакции с целью получения заданной массы или объема определенного вещества необходимо учитывать содержание примесей в

Рис. 51.
Содержание примесей в химическом реактиве
реагентах. Для твердых и жидких веществ указывают массовые доли примесей, а для газов, как правило, — объемные доли.
Рассмотрим, как выполняют вычисления по химическим уравнениям, когда реагенты имеют примеси. Условимся, что эти примеси не принимают участие в реакциях.
ЗАДАЧА 1. Какой объем водорода выделится (н. у.) при взаимодействии 1,25 г магния с достаточным количеством этановой кислоты, если массовая доля примесей в металле равна 4 %?

Решение
1. Определяем массовую долю магния в образце металла, содержащем примеси:
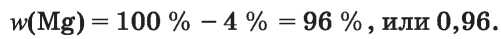
2. Рассчитываем массу и количество вещества магния (без примесей):
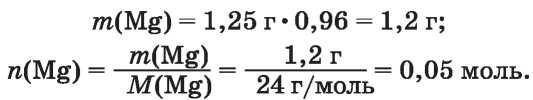
3. Находим объем водорода при нормальных условиях. Учитываем, что в соответствии с химическим уравнением 1 моль магния вытесняет 1 моль или 22,4 л (н. у.) водорода:
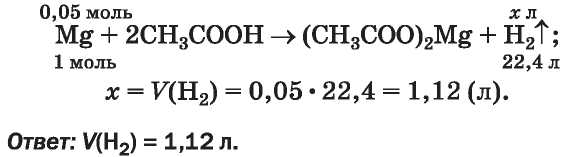
ЗАДАЧА 2. В результате сгорания 6,15 г этанола, содержавшего примесь воды, образовалось 5,6 л углекислого газа (н. у.). Определить массовую долю примеси в спирте.

3. Определяем количество вещества спирта (без примеси воды).
Поскольку из 1 моль спирта в соответствии с химическим уравнением образуется 2 моль (т. е. вдвое больше) углекислого газа
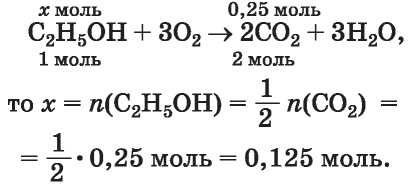
4. Находим массу спирта (без примеси воды):
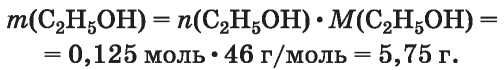
5. Рассчитываем массу и массовую долю примеси воды в спирте:
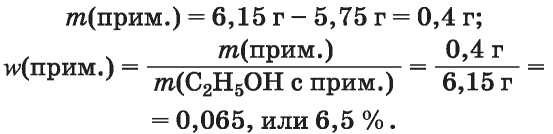
2-й способ
1. Определяем массу спирта (без примеси), который вступил в реакцию. Для этого составляем уравнение реакции с соответствующими записями над и под формулами веществ:
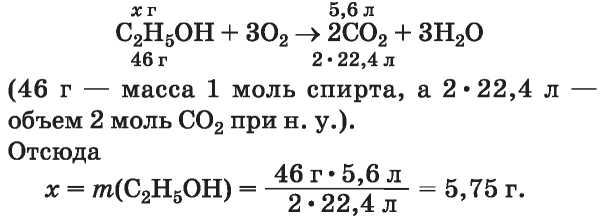
2. Вычисляем массовую долю спирта в его смеси с примесью (водой):
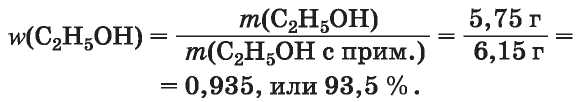
3. Находим массовую долю примеси воды в спирте:
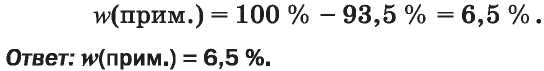
выводы
Количественные расчеты химических превращений с участием веществ, содержащих примеси, проводят в два этапа. Сначала определяют массу, объем или количество вещества реагента без примесей, а затем, по уравнению реакции, — массу, объем или количество вещества продукта.
147. Какую максимальную массу этанола можно получить из 25 м3 этена (н. у.), если этот углеводород содержит 8 % этана?
148. При дегидратации 16,7 г пропан-1-ола, содержащего примесь воды, образовалось 5,6 л углеводорода (н. у.). Определите массовую долю воды в спирте.
149. Содержал ли фенол заметное количество примесей, если для реакции с натрием взяли 23,6 г фенола, а получили 29 г фенолята?
150. Какую максимальную массу этаналя можно получить из 20 г кальций карбида, в котором содержится 12 % примесей?
151. Какой объем водорода (н. у.) выделится в результате взаимодействия 2 г лития с достаточным количеством муравьиной кислоты, если массовая доля примесей в металле равна 3 %?
152. Вычислите массовую долю примесей в этене, если для реакции с бромом взяли 3,7 г этого газа, а прореагировало 20 г брома.
153. Найдите массу углекислого газа, образовавшегося при сжигании 1 т угля в избытке воздуха, если суммарная массовая доля всех элементов в угле, кроме Карбона, составляла 10 %.
Это материал учебника Химия 10 класс Попель, Крикля
Наступна сторінка: 21. Эстеры