Попередня сторінка: 2. Az atom elektronszerkezete
Наступна сторінка: 4. A kémiai elem jellegének, egyszerű és összetett vegyületei tu...
E téma tananyaga segít nektek:
tisztázni a vegyérték fogalmát; felidézni az atom gerjesztett állapotának fogalmát;
prognosztizálni az elem lehetséges vegyértékeit; meghatározni az oxidációs szám értékét a ve-gyületek képletei alapján.
A kémiai elemek vegyértéke. A nyolcadik osztályos tananyagból ismeretes, hogy az atomok párosítat-Ian elektronjai közös elektronpárt hoznak létre (kovalens kötés), az elem vegyértéke pedig a kialakított közös elektronpárok számával határozható meg.
A szerves vegyületekben az első három kötéstípus fordul elő. A szerves vegyületekben a kovalens kötés a legelterjedtebb, mivel ezek molekuláris szerkezetűek, amire ez a kötés jellemző. Minden hidrogénatomnak egy elektronja van (Is1), ami részt vesz a kötés kialakításában. Ezért a hidrogén I vegyértékű:
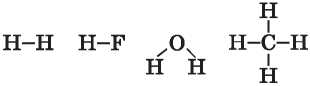
A fluor szintén I vegyértékű, az oxigén vegyértéke viszont II. Ez azzal magyarázható, hogy a
fluor külső elektronhéján egy párosítatlan elektron van, az oxigénnek pedig kettő:
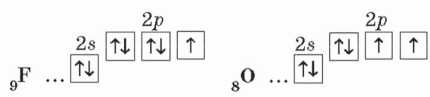
Vagyis a párosítatlan elektronok száma rámutat a kémiai elem lehetséges vegyértékére.
Némely elem atomjának elektronszerkezete megváltozhat. Ennek egyik feltétele, hogy a külső energiaszinten1 legyen üres cella vagy alhéj. Ha az alapállapotú atomhoz megfelelő mennyiségű energiát közlünk, a külső elektronhéjon található párosított elektronok egyike távolabb kerül az atommagtól és szabad cellába költözik. Ilyenkor az atom gerjesztett állapotáról beszélünk (csillaggal jelölik az elem vegyjelétől jobbra fent). Gerjesztett állapotban a párosítatlan elektronok száma nő, így több kovalens kötést képes kialakítani. Ezzel a jelenséggel a szerves kémia tananyagában találkozhattatok a szénatom esetében:
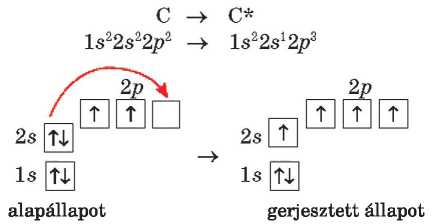
A szén négy-vegyértékűségét a gerjesztett állapotú szénatom négy párosítatlan elektronja okozza.
Több nemfémes elem is létezhet gerjesztett állapotban: bőr, szilícium, foszfor, kén, klór és más elemek. Amíg az első három elem atomja

számára gerjesztett állapot jellemző, addig a kénatom és a klóratom két-, illetve háromféle gerjesztett állapotban létezhet.
írjátok fel a bóratom elektronszerkezetét gerjesztett állapotban.
A szilíciumatom esetében gerjesztett állapotban egy 3s-elektron átmegy a Зр-cellába, a foszforatom gerjesztésénél a 3s-elektron emissziója a 3d-alhéjra történik:

A szilícium, mint a szén, majdnem minden vegyületében négy-vegyértékű (az atom gerjesztett állapotában négy párosítatlan elektron található). A foszfor vegyértéke lehet III (alapállapotban 3 párosítatlan elektronnal rendelkezik) vagy V (gerjesztett állapotban 5 párosítatlan elektronja van). A foszfor változó vegyértékének példája lehet a PH3 képletű foszfin és az ortofoszforsav - H3PO4.
A kén- és a klóratomok gerjesztésénél a 3s- és Зр-alhéjakon tartózkodó elektronok a 3d-atompályára kerülnek. Ez a folyamat a kén esetében a következőképpen néz ki:
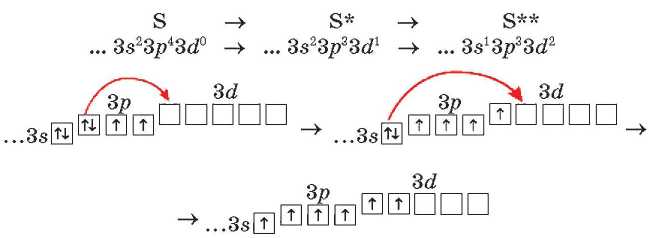
A két-, négy- és hat-vegyértékű kénvegyületek példái: H2S - kénhidrogén, SO2 - kén(IV)-oxid, H2SO4 - kénsav. A nitrogén-, az oxigén- és a fluoratomok nem geijeszthetők, mivel a külső, második energiaszinten nincs üres cella.
A 2. és 3. periódus nemfémes elemek vegyértékéről az 1. táblázat ad információt:
1. táblázat
A 2. és 3. periódus nemfémes elemeinek vegyérték-lehetőségei1
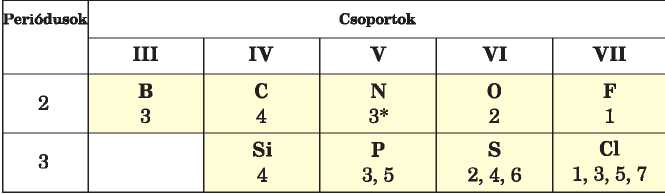
* A nitrogén maximális IV vegyértéke az ammónium-ionban lehetséges (6. §).
Az oxidációs szám. Az oxidációs szám a vegyületben található kémiai elem fontos jellemzője. Ezt a jellemzőt alkalmazzák az anyagok osztályozásánál, az oxidációs-redukciós folyamat lehetőségének megjóslásánál, valamint a redoxi egyenletek rendezésénél jelent nagy segítséget az atomok oxidációs állapotának, illetve oxidációs számának ismerete.
Milyen oxidációs számmal rendelkeznek az elemek az egyszerű anyagok molekuláiban?
Tanulmányaitok során ismeretet szerezhettetek arról, hogy a bináris ionos vegyületekben minden elem oxidációs szám értéke megegyezik az ion töltésével. így a Htium-kloridban az oxidációs számok értéke +1
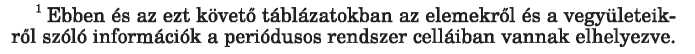
és —1, az aliimfniiim-Hzulfid esetében az elemek oxidációs száma +3 és -2:

A molekuláris és atomszerkezetű anyagokban viszont kovalens kötés van az atomok között. Az oxidációs szám kiszámításánál a poláris kovalens kötés részlegesen eltolódott közös elektronpáiját gondolatban a nagyobb elektronegativitású atomhoz rendeljük, és az így kialakult töltés lesz az elem oxidációs száma (ehhez használjuk az 1. függelékben található Elemek elektronegativitása nevű táblázatot):
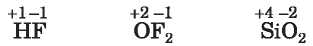
Három vagy több elemből álló vegyületek esetén az oxidációs szám értékét az anyag elektromos semlegességének szabálya szerint határozzuk meg: semleges vegyületekben az alkotó atomok oxidációs számának összege nullával egyenlő. Alább található két példa az oxidációs szám felírására:

Határozzátok meg az alábbi képletekben az elemek oxidációs számát: Li3N, SCl2, HClO4.
Az atom gerjesztett állapotának köszönhetően megnövekedik az elem vegyérték-lehetősége és az oxidációs állapotok száma is (2. táblázat). A vegyületek megnevezésében is feltüntetik az oxidációs szám értékét (római számmal „+” vagy előjel nélkül):

2. táblázat
A 2. és a 3. periódus elemeire jellemző oxidációs számok

* A nitrogén +5 oxidációs számát képlet szerint számítással határozzák meg, nem pedig a kötő elektronpár eltolódásával.
A vegyérték és az oxidációs szám fogalma. Nem szabad összetéveszteni és felcserélni egymással a vegyérték és az oxidációs szám fogalmát, mivel ezek jelentése tartalmilag különböző. A vegyérték az atomok között kialakuló kovalens kötések számával határozható meg, míg az oxidációs szám alatt az atomnak feltételes egész számú töltését értjük, amelyet úgy kapunk, hogy a kötést kialakító elektronokat az elektronegatívabb atomhoz rendeljük.
Az elem vegyértéke és oxidációs számának értéke a vegyületekben gyakran egybeesik (figyelmen kívül hagyva az előjeleket). így például a széndioxidban (CO2) a szén vegyértéke is IV és oxidációs száma is +4; a kénhidrogénben (H2S) a kén vegyértéke II, oxidációs száma -2. Vannak azonban olyan esetek is, amikor a számbeli értékek nem egyeznek: például az elemmolekulákban, egyes vegyületekben. A Cl2 képletű klórmolekulában a klóratom vegyértéke I (az atomok között egyszeres kovalens kötés található Cl-Cl), az oxidációs szám értéke pedig nullával egyenlő. A H2O2 képletü hidrogén-peroxidban a hidrogén I, az
oxigén II vegyértékű (grafikus képlete H-O-0-H), oxidációs számuk: a hidrogénnek +1, az oxigénnek -1.
Az 1. és 2. táblázat adatai arról tanúskodnak, hogy az elemek vegyértéke és az oxidációs szám értéke a főcsoportok elemeinél a legtöbb esetben azonos. Ez a tendencia vehető észre a mellékcsoportok elemeinél is.
ÖSSZEFOGLALÁS
A párosítatlan elektronok száma az elem lehetséges vegyértékeire mutat. Az atom gerjesztése során a párosított elektronok külön cellákba kerülnek, így megnő a párosítatlan elektronok száma. A gerjesztési folyamat feltétele megfelelő mennyiségű energia közlése, valamint üres cella vagy alhéj megléte, amelyre át tud menni az elektron.
A gerjesztésnek köszönhetően megnő az elem vegyérték-lehetősége, valamint az oxidációs szám különböző értékének mennyisége.
A magtöltés növekedésével a vegyérték és az oxidációs szám értéke változásának periodicitása figyelhető meg.
23. A felsorolt elemek között - H, C, N, F, Si - melyik elem:
a) található csak alapállapotban;
b) atomjaira milyen gerjesztett állapot jellemző?
24. A klóratom alapállapotból gerjesztett állapotba való átalakulásának vázlata:

írjátok fel a klóratom minden állapotának rövid beírásos elektronszerkezeti képletét és cellásán ábrázolva.
25. A felsorolt klórvegyületek közül melyikben található a klóratom gerjesztett állapotban: Cl2O, SCl4, HClO3, Cl2, Cl2O7, ClF3.
26. Az 1. és 2. táblázatból vajon miért hiányoznak a VIII. csoport elemei: a neon és az argon?
27. Milyen vegyértékkel és milyen oxidációs számmal rendelkezik a szén a metánban, az etánban, az eténben és az etinben?
28. Melyik a helyes befejezése az alábbi mondatnak: Egyszerű anyagokban nullával egyenlő...
a) a vegyérték és az oxidációs szám;
b) az atom vegyértéke;
c) az oxidációs szám értéke?
29. Az alábbi képletű vegyületekben határozzátok meg a foszfor oxidációs számát: Ca3P2, PBr5, HPO3.
30. A berillium és a magnézium két olyan elem, melyeknek állandó és azonos (mennyi?) az oxidációs száma. Indokoljátok meg, hogy minek köszönhető a két elemnek ez a tulajdonsága?
Ez a tankönyv anyaga Kémia a 11. osztály számára Pavlo Popéi
Наступна сторінка: 4. A kémiai elem jellegének, egyszerű és összetett vegyületei tu...