Попередня сторінка: 26. A bázisok. A nátrium és a kalcium hidroxidja
Наступна сторінка: 28. A víz keménysége
E téma tananyaga segít nektek:
bővíteni a sókkal kapcsolatos tudásotokat, információhoz jutni a természetben való elterjedésükről; új ismereteket szerezni a sók tulajdonságairól.
A sók a szervetlen vegyületek egyik legfontosabb csoportja. Találkoztatok már velük a 8. osztályos tananyagban.
A sók - ionos vegyületek, amelyek összetételében fémes elemek vagy ammonium kationja és savmaradék anionja található.
Elterjedésük a természetben. A földkéreg összetételében számos só található. Majdnem mind vízben nem oldódó. Vannak közöttük szibkátok, karbonátok (77. ábra), szulfidok, foszfátok. A kalcium-karbonát az ásványok mellett a teknősök, a korallok, a tojáshéj anyagának összetevője.
A természetes vizekben fém-kationok és savma-radék-anionok találhatók, vagyis a víz oldott sókat tartalmaz. A víz elpárologtatósával vízben oldódó sók kristályai maradnak vissza (a tengervízből pél-
dául nátrium-klorid, kálium-klorid). Az ókorban az ilyen sók kivonódása és lerakódása következett be, és kialakultak a mai sókészletek.

77. ábra
Sószerű
ásványok
A sók osztályozása. Összetételük alapján a sóknak három alapvető típusát különböztetjük meg (7. vázlat):
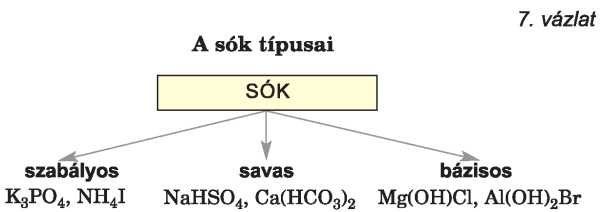
A szabályos (semleges) sók. A szabályos sókhoz tartoznak az olyan képletű vegyületek, mint a
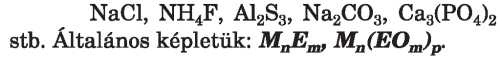
A szabályos sókban tehát csak fém és savmaradék fordul elő, mert a savnak helyettesíthető hidrogénje fém- vagy ammóniumionnal van pótolva:
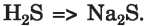
Úgy is vehetjük, hogy a bázisban vagy az amfoter hidroxidban az OH--anionok teljesen behelyettesítődnek savmara-dék-anionnal:
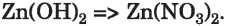
A szabályos sók elnevezését a fém kation nevéből és a savmaradék anion nevéből képezzük. Ha a fémnek változó a vegyértéke, akkor az adott vegyértéket zárójelben külön is jelöljük.
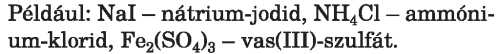
A savanyú sók. Ezekről a sókról a 12. §-ban már volt szó; a szabályos sók hidrolízisénél alakulnak ki, ha az anion egynél magasabb töltéssel rendelkezik. Ilyen sók: NaHCO3, NH4HS, KH2PO4, K2HPO4. Mindegyik vegyület anionja hidrogéntartalmú savmaradék. A szénsavnál (H2CO3) ez a HCO3-ion (a szénsav disszociációjának I. fokozata), az ortofoszforsav (H3PO4) esetében két ion is lehetséges: a H2PO4 és a HPOf-(a disszociáció első és második lépése). A savanyú sókban tehát a fémen és a savmaradékon kívül még hidrogén is előfordul, mert a savnak hidrogénje csak részben van fémmel pótolva; éppen ezért savanyú sók csak két vagy több bázisú savakból keletkezhetnek.

A savanyú sók elnevezését a fém kation nevéből és a hidrogéntartalmú savmaradék anion nevéből képezzük, jelezve a hidrogének számát (ha kettő vagy több van benne):
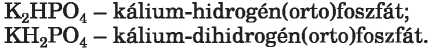
A bázisos sók. Ezek is a szabályos sók hidrolízisénél alakulnak ki (12. §). Az ilyen sók két vagy több hidroxidot tartalmazó bázisokból vagy amfoter hidroxidokból keletkezhetnek
Mg(OH)Cl, Al(OH)SO4, Al(OH)2NO3. Bázisos só keletkezik, ha a bázisban vagy az amfoter hidroxid-ban az OH--anionok nem helyettesítődnek be teljesen savmaradék-anionnal. így a kation hidroxid-tartalmú. A Mg(OH)2 bázisnak a MgOH+-kation felel meg, az Al(OH)3 amfoter hidroxidnak az Al(OH)2- és Al(OH)2-kationok felelnek meg. A bázisos sókban tehát a fémen és a savmaradékon kívül még hidroxid (OH) is előfordul
A bázisos sók elnevezését tartalmazó fém kation nevéből, hozzátéve a hidroxid-szót (jelezve az OH-csoport számát, ha kettő vagy több van benne) és a savmaradék anion nevéből képezzük:
Mg(OH)Cl - magnézium-hidroxid-klorid; Fe(OH)2NO3 - vas(III)-dihidroxid-nitrát.
A sók tulajdonságai. Számos só oldódik a vízben. Az oldat bepárlása után gyakran kristályvíztartalmú sók keletkeznek (78. ábra), melyek színét többnyire a hidratált kation határozza meg.

78. ábra
Kristályvíz
tartalmú
nitrátsók
Vízben nem oldódó sók az ezüst-klorid, a bárium-szulfát, a karbonátok, az ortofoszfátok, a szulfidok többsége és mások (II. előzék). A sóknak ezt a tulajdonságát ionok vizes oldataikban történő kimutatására használják, vagyis a minőségi reakcióknál (31. §). Az ezüst, az ólom, a kalcium-szulfátok vízben csak kis mértékben oldódnak. A savanyú sók viszont jobban oldódnak, mint a megfelelő szabályos sók.
Elektrolitos disszociáció és hidrolízis. Vizes oldataikban a sók megfelelő ionokra bomlanak (disszociálnak):
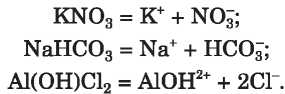
írjátok fel az alábbi sók elektrolitos disszociációjának egyenletét: Ii2SO4, NaH2TO4, Fe(OH)2NO3.
A gyenge bázisokkal vagy gyenge savakkal alkotott sók vizes oldataikban hidrolizálnak (12. §):
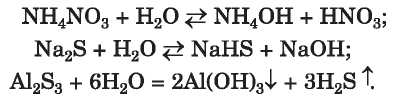
Érdekes
tudnivaló
Az aktív fémek egyes sók olvadékaival is reagálnak (klori-dokkal, fluori-dokkal). így állítják elő például az uránt érceiből.
A sók reakciója fémekkel. A sók vizes oldataikban reakcióba lépnek a fémekkel, miközben új só és fém keletkezik. A sóban található fémionok minden olyan fémmel leválaszthatók, amelyek a fémek aktivitási sorában megelőzik őket:
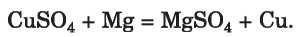
A sók reakciója lúgokkal, savakkal, más sókkal. Mivel a sók ionokból állnak, így ezek az anyagok ionos cserebomlásban vesznek részt. A sók reakciója lúgokkal, savakkal, sókkal -cserebomlási reakció, ami akkor megy végbe, ha a leendő reakciótermékek között vízben nem oldódó vagy kevésbé oldódó vegyület, gáz vagy gyenge elektrolit van. A vízben oldódó szulfátok cserebomlási reakciójának példái:
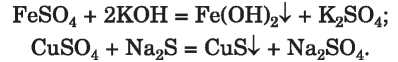
Savakkal a szulfátok általában nem lépnek kölcsönhatásba, mert a kénsav erős, nem illékony sav.
Válasszatok a nátrium-ortofoszfáthoz megfelelő reagenst - egy lúgot, egy savat és egy sót, és írjátok fel a három reakcióegyenletet.
A savas vagy a bázisos sókat szabályos sókká lehet alakítani, hozzáadva szükségszerűen lúgot vagy savat:
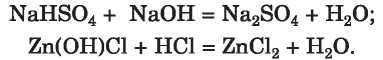
Lehetséges és ellentétes átalakítások:
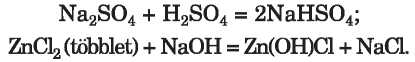
A sók termikus bomlása. Egyes oxigéntartalmú sók hő hatására felbomlanak. A karboná-
tok és a szulfátok hőbomlásának terméke a sót alkotó megfelelő bázisképző és savképző oxid:
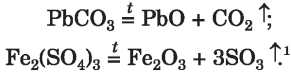
A nitrátok termikus bomlása a só összetételében levő fém kémiai aktivitásától függően különbözőképpen megy végbe, de mindegyiket (kivétel az ammónium-nitrát) oxigénfejlődés kíséri (8. vázlat).

Példák a megfelelő reakciókra:
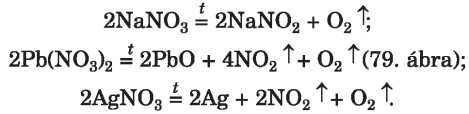

79. ábra
Oxigén kimutatása ólom(ll)-nitrát bomlásánál
Az alkáli fémek sóira nem jellemző a hőbomlás (karbonátok, szulfátok), egyes sók azonban az oxidációs szám változásával bomlanak:
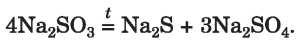
Ha a só összetételében a savmaradéknak megfelelő anhidrid szilárd savképző oxid

(pl. P2O5, SiO2) vagy amfoter-oxid, akkor a só hő hatására nem bomlik fel.
Alkalmazás. A sók alkalmazási területe -összehasonlítva az oxidokkal, bázisokkal, savakkal - szélesebb körű és jelentősebb (9. vázlat).
9. vázlat
Sók alkalmazása
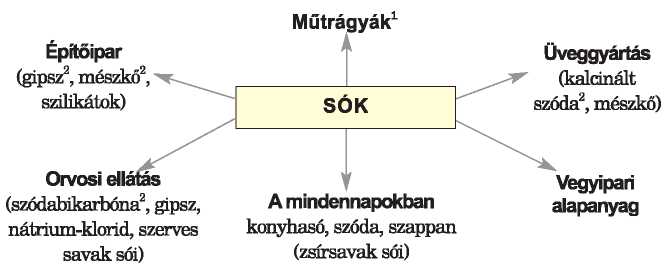

Erősen higroszkopikus hatása miatt a kalcium-kloridot gázok szárítására, az egyes oldatokban található nem kívánt vízmennyiség eltávolítására használják; jéggel keverve hűtőkeverék. A réz(II)-szulfát pentahidrát, vagy más néven rézgáhc CuSO1 • 5H20, a bordói lé összetevője, amit permetezésre, a növények betegsége és kártevői ellen használnak. A kálim, nátrium- és ammónium-nitrátot robbanószerek gyártására, a lítium-, strondum- és bárium-nitrátokat pirotechnikai keverékek előállítására alkalmazzák. A kalrium-, a nátrium- és az ammónium-foszfátok savanyú sói takarmány-adalékanyagként szolgálnak az állattenyésztésben.
ÖSSZEFOGLALÁS
A sók olyan vegyületek, amelyek összetételében fémes elemek (vagy ammonium) kationja és savmaradék anionja található.
Szabályos, savanyú és bázisos sókat különböztetnek meg. A savanyú sókban hidrogén-tartalmú anionok vannak, a bázisos sókban pedig hidroxidtartalmú kationok.
A sók oldataikban reakcióba lépnek a fémekkel, a lúgokkal, a savakkal, más sókkal. A sók többségének vizes oldatában hidrolízis megy végbe. Némely só melegítés hatására felbomlik.
A sók gyakorlati alkalmazása széleskörű.
214. Miben különbözik a szabályos sótól:
a) a savanyú só;
b) a bázisos só?
215. Alkothat-e savanyú sót a sósav, a kénsav, a salétromsav? Ha igen, írjátok fel a kálium és kalcium megfelelő savanyú sóit.
216. írjátok fel a kalcium-ortofoszfát savanyú sóit, valamint a króm(III)-klorid bázisos sóit és nevezzétek meg őket.
217. írjátok fel a magnézium-nitrát valamilyen lúggal, ammónium-karbonáttal és kénsavval történő reakciójának kémiai egyenletét. Jelezzétek a reakció lefolyásának körülményeit.
218. írjátok fel azoknak a reakcióknak az egyenletét, mely segítségével elvégezhetők a következő vázlat szerinti átalakítások:
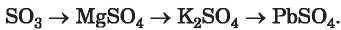
219. Milyen reagens segítségével lehet előállítani almnínium-szulfátot:
a) Al(OH)SO4 képletű sóból;
b) Al(HSO4)3 képletú sóból.
220. írjátok fel a lítium-, a vas(III)- és a higany(II)-nitrát termikus bomlásának reakcióját, és az elektronmérleg módszer segítségével alakítsátok át kémiai egyenletté.
221. Lúgoldatot, mely 17,1 g bárium-hidroxidot tartalmazott, összekevertek 29,4 g ortofoszforsavat tartalmazó oldattal. Határozzátok meg, milyen só képződött és milyen tömegben.
222. Számítsátok ki a keletkező gázok össztérfogatát (n.k.k.), amely 7,4 g magnézium-nitrát termikus bomlásánál keletkezik.
223. 3,7 g kalcium-hidroxidhoz 8,4 g salétromsavat tartalmazó oldatot adtak. Melyik anyag nem használódott el teljesen? Határozzátok meg a maradék tömegét.
224. A kálim-nitrát melegítése során a szilárd anyag elveszítette tömegének 10%-át. Milyen vegyületeket tartalmaz a szilárd maradék a reakció után? Határozzátok meg a vegyületek tömegrész-arányát a keletkezett keverékben.
225. Mint kiderült, a réz(II)-ortofoszfát tömege, amit rézgálicból -CuS04 • 5H20 és megfelelő mennyiségű ortofoszforsavból állítottak elő, kétszer kevesebb, mint a kiinduló rézgálic tömege. Határozzátok meg a réz(II)-ortofoszfát termékhozamát.
Ez a tankönyv anyaga Kémia a 11. osztály számára Pavlo Popéi
Наступна сторінка: 28. A víz keménysége